
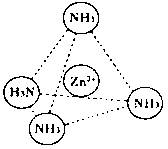

科目:高中化学 来源:不详 题型:填空题
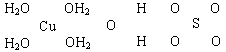
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是: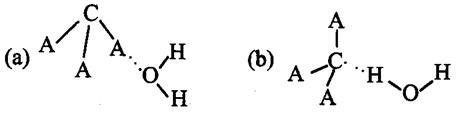
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 性键
性键| A.只有②⑤⑥⑦ | B.只有②⑤⑥ | C.只有①②③⑤⑥⑧ | D.只有②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 同特征:方向性和饱和性
同特征:方向性和饱和性 性键的分子都是极性分子
性键的分子都是极性分子| A.①② | B.⑥ | C.③④⑤ | D.①②⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
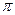 键数目为 。
键数目为 。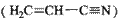 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。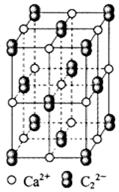
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
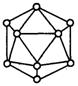
| A.20个,60个,360° | B.12个,30个,60° |
| C.9个,18个,45° | D.18个,54个,90° |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体 |
| B.制造光导纤维的主要材料是高纯度硅,属于原子晶体 |
| C.H2O分子比H2S分子稳定是因为水分子之间存在氢键 |
| D.NaCl和MgO晶体熔融时克服的作用力相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
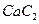 与水反应生成乙炔。
与水反应生成乙炔。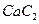 中
中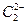 与
与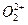 互为等电子体,
互为等电子体,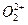 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol 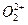 中含有的
中含有的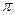 键数目为 。
键数目为 。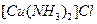 溶液生成
溶液生成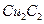 红棕色沉淀。
红棕色沉淀。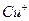 基态核外电子排布式为 。
基态核外电子排布式为 。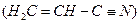 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
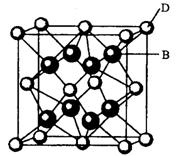
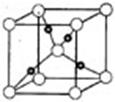
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。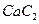 晶体的晶胞结构与
晶体的晶胞结构与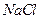 晶体相似(如图所示),但
晶体相似(如图所示),但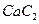 晶体中含有的中哑铃形
晶体中含有的中哑铃形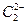 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。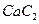 晶体中1个
晶体中1个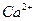 周围距离最近的
周围距离最近的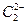 数目为 。
数目为 。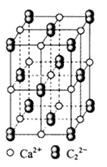
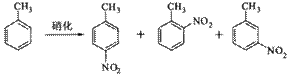
 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
 NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com