


科目:高中化学 来源: 题型:
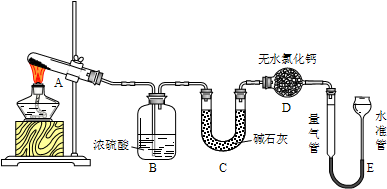
| 实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
| ① | T1 | 0.640 | 0.320 | 0 | 0 |
| ② | T2 | 0.640 | 0 | 0.256 | V2 |
| ③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
| ④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
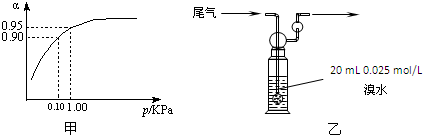
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
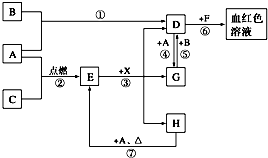 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com