
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_________吸收。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(2)用稀硫酸浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_______(填离子符号),检验溶液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学方程式为_________________________________。
(4)以CuSO4溶液 为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的
为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的 是__________。
是__________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4====2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_______________________。
(1)从冰铜的元素组成上看,其中含有硫元素,焙烧产物泡铜和熔渣中不再含有硫元素,故可推知A一定为SO2, 一般选用碱液吸收,故答案为c、d。
(2)向溶液中滴加KSCN溶液,溶液呈红色,可推知溶液中一定含有Fe3+;要检验溶液中还含有Fe2+,可取适量酸性KMnO4溶液于一支试管中,滴入几滴该溶液,若酸性高锰酸钾溶液褪色或变浅,说明该溶液中含有Fe2+。
(3)泡铜制取粗铜,是Cu2O和铝发生氧化还原反应,根据氧化还原反应的配平方法进行配平可得,化学反应方程式为3Cu2O+2Al Al2O3+6Cu。
Al2O3+6Cu。
(4)在电解过程中,会有一部分电能损失转化为热能,因此电能不可能全部转化为化学能,a错误;c项,溶液中的Cu2+应向阴极(精铜)移动,c错误;正确答案为b、d。
(5)通过化学反应可以看出,O2 发生还原反应,正极反应物一定为O2,其对应的还原产物为H2O,故正极的电极反应为O2+4e-+4H+====2H2O。
答案:(1)c、d
(2)Fe3+ 可取适量酸性KMnO4溶液于一支试 管中,滴入几滴该溶液,若酸性高锰酸钾溶液褪色或变浅,说明该溶液中含有Fe2+
管中,滴入几滴该溶液,若酸性高锰酸钾溶液褪色或变浅,说明该溶液中含有Fe2+
(3)3Cu2O+2A l
l Al2O3+6Cu
Al2O3+6Cu
(4)b、d
(5)O2+4e-+4H+====2H2O


科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
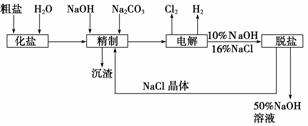
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为________________________,与电源负极相连的电极附近,溶液pH________(选填“不变”、“升高”或“下降”)。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程中除去这些杂质时发生反应的离子方程式为________________________________________________________________________、
________________________________________________________________________。
(3)如果粗盐中SO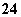 含量过高,必须添加钡试剂除去SO
含量过高,必须添加钡试剂除去SO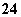 ,该钡试剂可以是________(填写字母序号,下同)。
,该钡试剂可以是________(填写字母序号,下同)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、SO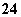 ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________
(填写操作名称)除去NaCl。
(6)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,得到的产物仅是NaClO和H2,则与该反应相应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 )。
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同
A.③④⑦⑧ B.①③④⑦⑧
C.①②⑤⑥⑨ D.①④⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别持有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入较浓的硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑两球的浮力变化)( )

A.当杠杆为绝 缘体时,A端高、B端低;为导体时,A端低、B端高
缘体时,A端高、B端低;为导体时,A端低、B端高
B.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
C.当杠杆为导体或绝缘体时,均为A端高B端低
D.当杠杆为导体或绝缘体时,均为A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
加碘食盐中的碘以碘酸钾 (KIO3)的形式存在。已知溶液中的IO3-和I-发生反应:IO
(KIO3)的形式存在。已知溶液中的IO3-和I-发生反应:IO 3-+5I-+6H+====3I2+3H2O。根据此反应,可用试纸和一些生活中常用的物质进行实验,证明食盐中存在IO3-,除食盐外可供选用的物质有:
3-+5I-+6H+====3I2+3H2O。根据此反应,可用试纸和一些生活中常用的物质进行实验,证明食盐中存在IO3-,除食盐外可供选用的物质有:
①自来水 ②蓝色石蕊试纸
③KI-淀粉试纸 ④淀粉
⑤白糖 ⑥食醋
⑦白酒
进行上述实验时必须使用的物质是( )
A.①③ B.③⑥
C.②④⑥ D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取气体的装置如图所示,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项正确的是( )
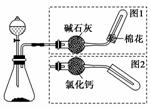
| 发生装置中的药品 | 干燥和集气装置 | |
| A | 过氧化钠和水 | 图2 |
| B | 大理石和稀盐酸 | 图1 |
| C | 铜和稀硝酸 | 图2 |
| D | 氯化铵和消石灰 | 图1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和解释都正确的是(双选)( )
| 选项 | 实验操作 | 现象 | 解释 |
| A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO |
| B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生成 | 铜离子可以氧化碘离子,白色沉淀可能成为CuI |
| D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法不正确的是( )
A.煤干馏可以得到甲烷、苯和煤焦油等重要化工原料
B.淀粉、纤维素和脂肪在一定条件下都可发生水解反应
C.用大米酿的酒在一定条件下密封保存,时间越长越香醇
D.“乙醇汽油”是在汽油中加入乙醇生成的一种新化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
把足量NaOH固体放入一定量的蒸馏水中,有NaOH(s) 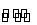 Na+(aq)+OH-(aq),一定温度下达到平衡。当向悬浊液中加少量过氧化钠后,若温度保持不变,下列判断正确的是( )
Na+(aq)+OH-(aq),一定温度下达到平衡。当向悬浊液中加少量过氧化钠后,若温度保持不变,下列判断正确的是( )
A.溶液中Na+数目增多
B.溶液中[Na+]增大
C.溶液pH不变
D.溶液pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com