
����Ŀ��CO ��ԭ������������Ч���������е�NOx���ŷ������ش��������⣺
I��CO ��ԭNO ��������Ӧ��2CO(g)��2NO(g) ![]() 2CO2(g)��N2(g) ��H
2CO2(g)��N2(g) ��H
��1����������ʻ�����л�����к�����CO��NO������֮���ܷ���������Ӧ:
�� �÷�Ӧƽ�ⳣ��K����ʽΪ_________��
�� �÷�Ӧ��K����570 KʱΪ1��1059����������������װ��β������װ�ã������ԭ����_______��
��2����Mn3O4 Ϊ������Ӧ�Ĵ������о���������·�Ӧ���̣������̲���������
��һ����_________��
�ڶ�����3MnO2��2CO��Mn3O4��2CO2
��3���ں��º��ݵ��ܱ������У���������ʵ�����CO ��NO ������壬����Mn3O4 ����������Ӧ��t0 ʱ�ﵽƽ�⣬��÷�Ӧ������CO2 �����������ʱ��Ĺ�ϵ����ͼ��ʾ��
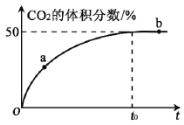
�� �Ƚϴ�С��a��v��______b��v������������������������=����
�� NO ��ƽ��ת����Ϊ_______��
II��T��ʱ���ڸ��Է�Ӧ���з������·�Ӧ��CO(g)��NO2(g) ![]() CO2(g)��NO(g)����ѧ��Ӧ����v =kPm(CO)Pn( NO2)��k Ϊ��ѧ��Ӧ���ʳ������о����������¶��·�Ӧ��ķ�ѹ�뻯ѧ��Ӧ���ʵĹ�ϵ���±���ʾ��
CO2(g)��NO(g)����ѧ��Ӧ����v =kPm(CO)Pn( NO2)��k Ϊ��ѧ��Ӧ���ʳ������о����������¶��·�Ӧ��ķ�ѹ�뻯ѧ��Ӧ���ʵĹ�ϵ���±���ʾ��
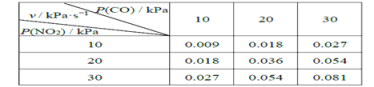
��4������Ӧ��ʼʱP(CO)=P(NO2)=a kPa����Ӧt minʱ�ﵽƽ�⣬�����ϵ��P(NO)=b kPa�����ʱv=_________kPa��s-1���ú���a��b�Ĵ���ʽ��ʾ����ͬ�����÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=_________��Kp���Է�ѹ��ʾ��ƽ�ⳣ������
���𰸡�K=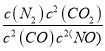 ��ѧ��Ӧ������ Mn3O4��2NO��3MnO2��N2 �� 80 % 9��10-5(a��b)2
��ѧ��Ӧ������ Mn3O4��2NO��3MnO2��N2 �� 80 % 9��10-5(a��b)2 ![]()
��������
(1)��ƽ�ⳣ��K����������Ũ���ݻ��뷴Ӧ��Ũ���ݻ�֮�ȣ��ڷ�Ӧ��ƽ�ⳣ������(570KʱΪ1��1059)������Ӧ���ʿ��ܼ�����
(2)���ݢ�2CO(g)+2NO(g)2CO2(g)+N2(g)����3MnO2+2CO=Mn3O4+2CO2�������
(3)��a�㷴Ӧ������У�b�㷴Ӧ�ﵽƽ��״̬���ڽ������ʽ��ʽ���㣻
(4)���ݱ������ݷ����жϻ�ѧ��Ӧ����v=k Pm(CO)Pn( NO2)��m=1��n=1���ݴ˼��㻯ѧ��Ӧ���ʳ���k������������ʽ��ʽ���㡣
I��(1)��ƽ�ⳣ��K����������Ũ���ݵĻ��뷴Ӧ��Ũ���ݵĻ�֮�ȣ����Է�Ӧ2NO(g)+2CO(g)N2(g)+2CO2(g)��ƽ�ⳣ��K=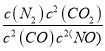 ���ʴ�Ϊ��K=
���ʴ�Ϊ��K=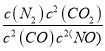 ��
��
�ڷ�Ӧ��ƽ�ⳣ��������Ӧ���ʼ�����װ��β������װ�ÿ���߷�Ӧ���ʣ�������β����ת�����ʣ��ʴ�Ϊ����ѧ��Ӧ��������
(2)��2CO(g)+2NO(g)2CO2(g)+N2(g)����3MnO2+2CO=Mn3O4+2CO2����Mn3O4Ϊ������Ӧ�Ĵ��������-�ڵõ���Ӧ�ĵ�һ����Mn3O4+2NO=3MnO2+N2���ʴ�Ϊ��Mn3O4+2NO=3MnO2+N2��
(3)��a�㷴Ӧ������У�v����v�������ŷ�Ӧ�Ľ��У�����Ӧ������С��b�㷴Ӧ�ﵽƽ��״̬v��=v�������a��v����b��v�����ʴ�Ϊ������
���ں��º��ݵ��ܱ������У���������ʵ�����CO��NO������壬�����ʵ���Ϊ1mol������ͼ��ƽ��ʱ��������̼�������50%�������ɵ���Ϊx��
2CO(g)+2NO(g)2CO2(g)+N2(g)��
��ʼ(mol)1 1 0 0
�仯(mol) 2x 2x 2x x
ƽ��(mol) 1-2x1-2x 2x x
��![]() =50%����ã�x=0.4mol��NO��ƽ��ת����=
=50%����ã�x=0.4mol��NO��ƽ��ת����=![]() ��100%=80%���ʴ�Ϊ��80%��
��100%=80%���ʴ�Ϊ��80%��
(4)��ѧ��Ӧ����v=k Pm(CO)Pn( NO2)��k Ϊ��ѧ��Ӧ���ʳ��������ͼ�����ݵõ���m=1��n=1����ѧ��Ӧ���ʳ���k=![]() ��
��
CO(g)+NO2(g)CO2(g)+NO(g)
��ʼ��/span> a a 0 0
�仯�� b b b b
ƽ���� a-b a-b b b
��ʱv=k P(CO)P( NO2)=![]() ��(a-b)(a-b)=9��10-5(a-b)2����Ӧǰ���������ʵ������䣬����ѹǿ���䣬������������ѹǿ���������ѹ����ƽ�ⳣ������K=
��(a-b)(a-b)=9��10-5(a-b)2����Ӧǰ���������ʵ������䣬����ѹǿ���䣬������������ѹǿ���������ѹ����ƽ�ⳣ������K=![]() ���ʴ�Ϊ��9��10-5(a-b)2��
���ʴ�Ϊ��9��10-5(a-b)2��![]() ��
��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵҵ�Һ�°��ڰ���Ļ����ϣ��������������Ƽ������������ͼ������������⣺
��1���ڱ���ʳ��ˮ��ͨ��X��Y����X____(����������)
��2��д��ͨ��X��Y�Ļ�ѧ��Ӧ����ʽ_____��
��3������Z____(������)��Ϊ�˵õ�����(NH4Cl)����Ҫ����ҺB��ͨ��NH3����ʳ�Σ�����ͨ��NH3������һ____�����ö�____��
��4����ҵ�����Ĵ���Ậ����NaCl���ʡ������������ⶨ�䴿�ȣ��������£��ٳ�ȡ��Ʒag����ˮ�ܽ⣻�ڼ���������BaCl2��Һ���۹��ˡ�___����ɡ���ȴ����������ɡ���ȴ��___�����յõ�����bg����Ʒ�д������������Ϊ____(�ú�a��b�Ĵ���ʽ)
��5��ij����С��Ҫ��NaOH��Һ��CO2���Ʊ�Na2CO3���壬����ֻ��δ֪Ũ�ȵ�NaOH��Һ50������������CO2�����ǵ���Ʒ����ǣ�����_____��Ȼ��_____������_____����____��������Ũ������ȴ�ᾧ�����˵ù���Na2CO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
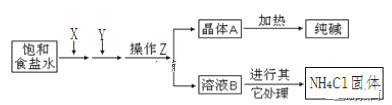
����Ŀ����̿����ԭ��������Ļ�ѧ����ʽΪ2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)��һ��ѹǿ�£���1L�ܱ������г��������Ľ�̿��1molSO2������Ӧ�����SO2������������S2(g)�������������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
S2(g)+2CO2(g)��һ��ѹǿ�£���1L�ܱ������г��������Ľ�̿��1molSO2������Ӧ�����SO2������������S2(g)�������������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
A. �÷�Ӧ��H>0B. C��ʱ�ﵽƽ��״̬
C. ����C�����ܹ�����SO2��ת����D. T3ʱ����ѹǿ�����������Ӱٷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
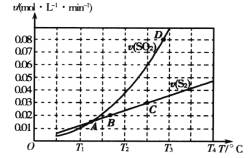
����Ŀ��H2RΪ��Ԫ���ᣬ��һ�������0.1mol/L��H2R��Һ����μ���һ��Ũ�ȵ�NaOH��Һ����Һ�в�ͬ��̬������(H2R��HR����R2��)�����ʵ�������a(X)��pH�ı仯������ͼ��ʾ[a(X)=c(X)/[c(H2R)+c(HR-)+c(R2-)]]������˵���������
A. �����£�K2��H2R��=1.0��10��11
B. �����£�HR����ˮ�еĵ���̶ȴ�����ˮ��̶�
C. pH=9ʱ�� c(Na+)>c(HR��)+2c(R2��)
D. pH=7ʱ��c(H2R)=c(HR��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ͬ������������ֱ�������������H2��CO2��O2������������������������¶Ⱥ��ܶȾ���ȣ�����˵����ȷ���ǣ� ��
A.ѹǿ��ϵ���٣��ۣ���B.������ϵ���٣��ۣ���
C.������Ŀ����=��=��D.ԭ����Ŀ���ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѣ�CH3OCH3����һ�����˻���ԭ�ϣ����м�����Ӧ���ܡ�
I�������ѵ������������ѵ�����ԭ��֮һ�����ü״���ˮ�ɶ����ѣ���ѧ����ʽ���£�
��Ӧi 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ��H 1
CH3OCH3(g) + H2O(g) ��H 1
��1����֪���״��������ѵ���̬��ȼ���ȷֱ�Ϊ-761.5 kJ��mol-1��-1455.2 kJ��mol-1����H2O(g) = H2O(l) ��H����44.0 kJ��mol��1����Ӧi����H 1��_________kJ��mol��1.
��2����Ӧi�м״�ת���ʡ�������ѡ���Եİٷ����벻ͬ�����Ĺ�ϵ���±���ʾ������ʱ��ѡ�����Ѵ�����_________��
���� | �״�ת����/% | ������ѡ����/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
ע����Ӧ��������ѹ���¶�270�����״�Һ�����14mL/(g��h)
��3��ѡ���������ƽ��ʱ�ļ״�ת�������¶ȵĹ�ϵ��ͼ��ʾ�����о�����ĵ���ɫ��ͼ���ָù�����Ҫ���ڵĸ���ӦΪ��
��Ӧii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ��H2����29.1kJ��mol��1
C2H4 (g)+2H2O(g) ��H2����29.1kJ��mol��1
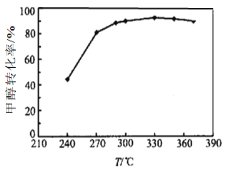
�� ��ҵ�����������ѵ��¶�ͨ����270-300��������330��֮�״�ת�����½���
���ݻ�ѧƽ���ƶ�ԭ��������ԭ�������_________��
���ݻ�ѧ��Ӧ���ʱ仯������ԭ�������_________��
�� ij�¶��£���CH3OH(g)Ϊԭ�ϣ�ƽ��ʱ�����ʵķ�ѹ�������±���
���� | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
��ѹ/MPa | 0.16 | 0.288 | 0.016 | �� |
��Ӧi�У�CH3OH(g)��ƽ��ת������=_________������ƽ���ѹ����ƽ��Ũ�ȼ��㣻���������λ��Ч���֡���
II�������ѵ�Ӧ�ã�
��4����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�����Ĺ���ԭ��ʾ��ͼ���õ�صĸ�����ӦʽΪ��_________��
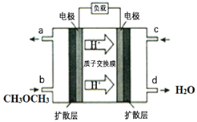
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ����Ӧ�������հ��У�
A.O2��O3
B.35Cl��37Cl
C.CH3CH2CH3��CH3CH2CH2CH3
D.H2��D2
E.CH3CH2CH2OH��CH3-O-CH2CH3
F.![]() C��
C��![]() N
N
��1������������Ϊͬλ��___��
��2�����������ʻ�Ϊͬ��������___��
��3����������������ͬϵ��___��
��4���������ʻ�Ϊͬ���칹��___��
��5������������ͬһ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��Ϊ������Ԫ�أ���ԭ������������������ݱ�����Ϣ�ش��������⣺
Ԫ�� | Ԫ�����ʻ�ṹ |
A | ���������������ڲ��������2�� |
B | BԪ�صĵ����ڿ����к������ |
C | CԪ���ڵؿ��к������ |
D | DԪ����ͬ�����н�������ǿ |
E | ���³�ѹ�£�EԪ���γɵĵ����ǵ���ɫ���壬���ڻ�ɽ�ڸ������� |
��1��E��Ԫ�����ڱ��е�λ��___��
��2��D������������ˮ���������ѧ�����ͣ�___��___��
��3��B��C��D��E�����Ӱ뾶�ɴ�С˳��Ϊ��___����Ԫ�ط��ţ���
��4���õ���ʽ��ʾE���⻯����γɹ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺���ݻ�Ϊ1L���ܱ������У�����1molCO2��3molH2����500���·�����Ӧ��CO2��g��+3H2��g��![]() CH3OH��g�� + H2O��g����ʵ����CO2��CH3OH��g�������ʵ�����n����ʱ��仯����ͼ1��ʾ��
CH3OH��g�� + H2O��g����ʵ����CO2��CH3OH��g�������ʵ�����n����ʱ��仯����ͼ1��ʾ��
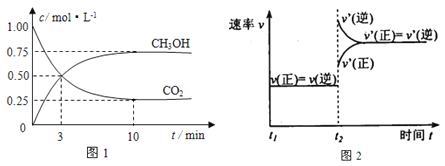
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2����_________________��500���ƽ��ʱ��CH3OH��g�����������Ϊ_______��ͼ2�Ǹı��¶�ʱ��ѧ��Ӧ������ʱ��仯��ʾ��ͼ����÷�Ӧ������ӦΪ____��Ӧ������ȡ������ȡ�����
��2��500��÷�Ӧ��ƽ�ⳣ��Ϊ_______��������λС������������¶ȵ�800����У���ƽ��ʱ��Kֵ_____���������С�����䡱����
��3�����д�ʩ�в���ʹCO2��ת�����������________________��
A����ԭ�������ٳ���1mol H2 B����ԭ�������ٳ���1molCO2
C����С�������ݻ� D��ʹ�ø���Ч�Ĵ��� E.��ˮ��������ϵ�з����
��4��500�������£����ijʱ�̣�CO2��g����H2��g����CH3OH��g����H2O��g����Ũ�Ⱦ�Ϊ0. 5mol/L�����ʱv������_____v���棩���������������=������
��5�����д�ʩ��ʹn��CH3OH��/n��CO2���������______��
A.�����¶� B.��ԭ�����г���1molHe
C.��ˮ��������ϵ�з���� D.��С�����ݻ�������ѹǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com