
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
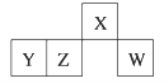
A. 原子半径:rW>rZ>rY>rX B. 含Y元素的盐溶液一定显酸性
C. 最简单气态氢化物的热稳定性:W>X D. Z的最高价氧化物的水化物难溶于水
【答案】D
【解析】
短周期元素X、Y、Z、W,W原子的最外层电子数是最内层电子数的3倍,若为2个电子层,则W的最外层电子数为6,所以W为O,由位置可知,不符合题意;若为3个电子层,则W的最外层电子数为6,所以W为S,由位置可知,X为N,Y为Al,Z为Si。据此分析。
短周期元素X、Y、Z、W,W原子的最外层电子数是最内层电子数的3倍,若为2个电子层,则W的最外层电子数为6,所以W为O,由位置可知,不符合题意;若为3个电子层,则W的最外层电子数为6,所以W为S,由位置可知,X为N,Y为Al,Z为Si,
A项,电子层越多,半径越大,具有相同电子层的原子序数越大其原子半径越小,则原子半径为rY>rZ>rW>rX ,故A项错误;
B项,Y为Al,AlCl3溶液显酸性,NaAlO2溶液显碱性,故B项错误;
C项,W为S,X为N,非金属性W<X,则最简单气态氢化物的热稳定性为W<X,故C项错误;
D项,Z为Si,Z的最高价氧化物的水化物为硅酸,难溶于水,故D项正确。
综上所述,本题正确答案为D。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室常用乙醇与浓硫酸的混合液加热的方法制取乙烯。反应中常因温度而发生副反应。请选用下列装置(装置可以使用多次)完成相关实验并回答有关问题:

(1)制备乙烯时,常在A装置的烧瓶中加入碎瓷片,其目的是__________;加热时要使溶液的温度迅速上升到140℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为__________;生成乙烯的化学方程式为___________。
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和CO2,为验证有副产物SO2和CO2气体存在,上述仪器的连接顺序为a→__________。
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D。已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2g·cm-3。
①E装置的作用__________。
②分离D装置中1,2-二溴乙烷的操作方法是加入试剂__________,充分反应后进行__________操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池可用于有机废水的处理,如图是利用微生物处理含尿素[CO(NH2)2]废水的装置。下列说法中正确的是

A. 该装置外电路中箭头的方向代表电流的方向
B. M电极反应式为CO(NH2)2-6e-+H2O=CO2↑+6H++N2↑
C. 当有1mlH+通过质子交换膜时,N极消耗5.6LO2
D. 该处理工艺会导致废水酸性增强,仍旧不能直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是

A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为3mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入3mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )

A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-![]() ) mol ④
) mol ④![]() mol
mol
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气分子式为(CN)2,其性质与卤素相似,在化学上称为类卤化合物,以下关于(CN)2的叙述错误的是( )
A.可与活泼金属直接发生化学反应
B.可溶于水,易溶于NaOH溶液
C.是一种无毒气体
D.可用HCN溶液与MnO2混合加热制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s) + 2NO(g) ![]() CO2(g) + N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g) + N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是

A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D. 在T2时,若反应体系处于状态D ,则此时v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①蔗糖 ②熔融NaCl ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO2 ⑦NaHSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩饱和FeCl3溶液
(1)上述物质中可导电的是_____(填序号,下同);
(2)上述物质中不能导电,但属于电解质的是_____。
(3)⑦在水溶液中的电离方程式为__________________________________。
(4)实验室制备少量Fe(OH)3胶体所用的物质有______(填序号)和蒸馏水,反应的离子方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com