
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ② | 溴苯(溴) | NaOH溶液 | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(环已烷) | 水 | 分液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH溶液 | B.AgNO3溶液 |
| C.Ba(OH)2溶液 | D.Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO和HCl | B.CH4和NH3 | C.CH4和HCl | D.H2和CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.结晶 | B.过滤 | C.蒸馏 | D.分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 (1)配制一定物质的量浓度的BaC12溶液:用已经称量好的 gBaC12固体配制0.4mol·L—lBaCl2溶液250 mL,所需要的仪器为量筒和 。
(1)配制一定物质的量浓度的BaC12溶液:用已经称量好的 gBaC12固体配制0.4mol·L—lBaCl2溶液250 mL,所需要的仪器为量筒和 。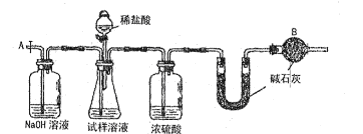
 实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是 。
实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是 。 陷是 。
陷是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Sr2+(aq)+SO2-4(aq)KSP=
Sr2+(aq)+SO2-4(aq)KSP= 2.5×10-7
2.5×10-7 Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9 论解释)
论解释) 液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。
液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| B.将氧气和氢气的混合气体通过灼热的氧化铜,以除去氧气中的氢气 |
| C.用溶解、过滤的方法分离SiO2和Fe2O3固体的混合物 |
| D.用分液的方法分离煤油和汽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com