
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 结构为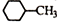 的一溴代物有5种 的一溴代物有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 |
分析 A、C4H10为丁烷,存在正丁烷与异丁烷两种同分异构体;
B、有机物中含有几种化学环境不同的H原子,就有几种一卤代物;
C、醛基为-CHO,剩余为丙基,丙基有2种;
D、羧酸具有-COOH,剩余为丁基,丁基有4种.
解答 解:A、C4H10为丁烷,有正丁烷与异丁烷两种同分异构体,故A错误;
B、有机物中含有几种化学环境不同的H原子,就有几种一卤代物, 中含有5种H,故其一溴代物有5种,故B正确;
中含有5种H,故其一溴代物有5种,故B正确;
C、醛基为-CHO,剩余为丙基,丙基有2种,故分子组成是C4H80属于醛类的同分异构体有2种,故C错误;
D、羧酸具有-COOH,剩余为丁基,丁基有4种,故分子组成是C5H10O2属于羧酸的同分异构体有4种,故D错误,
故选B.
点评 本题主要考查的是同分异构体个数的判断,难度较大,注意给定的条件以及熟练掌握各种简单烃基的个数是解决本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
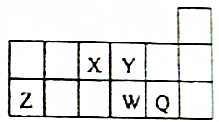 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10 mL0.1 mol•L-1Na2CO3溶液逐滴滴加到10 mlL0.1 mol•L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | 物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 | |
| C. | 向0.1mol•L-1的FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液不褪色,说明FeCl3只有氧化性,无法被氧化剂氧化 | |
| D. | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3浓溶液,可观察到大量淡黄色沉淀与少量白色沉淀,说明Ksp(AgCl)>Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
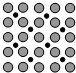 ①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①②③ | B. | ④③②① | C. | ④①③② | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若mXa+与nYb-符合题目要求,则m+a=n-b | |
| B. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定小于HnY | |
| C. | X,Y一定不是相邻周期元素 | |
| D. | 若X,Y处于同一周期且X离子所带电荷多于Y离子,则离子半径一定为:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | C | C. | KNO3、S | D. | N2、CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com