
| A.3号到9号元素化合价的变化与11到17号元素化合价的变化完全相同 |
| B.同周期原子半径逐渐减小,所以离子半径也逐渐减小 |
| C.随着原子序数的递增,碱金属元素单质的还原性逐渐增强,阳离子的氧化性逐渐减弱 |
| D.甲乙电子层数相同,甲的最高价氢氧化物的碱性比乙的最高价氢氧化物的碱性强,说明甲的核电荷数比乙大 |


科目:高中化学 来源:不详 题型:单选题
| A.氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢 |
| B.向硫化氢的水溶液中通入氯气可得到淡黄色的硫 |
| C.氯气能与水反应而硫不能 |
| D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgCl2 | B.CaCl2 | C.SiO2 | D.CS2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
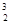 He,每百吨
He,每百吨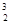 He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于
He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于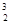 He的说法正确的是
He的说法正确的是A.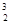 He原子核内含有2个中子 He原子核内含有2个中子 | B.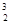 He原子核内含有3个质子 He原子核内含有3个质子 |
C.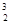 He原子核外有3个电子 He原子核外有3个电子 | D.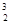 He和 He和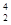 He是两种不同的核素 He是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 与R-可发生反应:RO
与R-可发生反应:RO +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )| A.元素R位于周期表中第ⅤA族 |
B.RO 中的R只能被还原 中的R只能被还原 |
| C.CaR2是离子化合物,阴阳离子电子层结构相同,且既含有离子键,又含有共价键 |
| D.3 mol R2中,氧化产物与还原产物的质量比为5︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 草酸钠晶体中存在 (填图中元素代号)。
草酸钠晶体中存在 (填图中元素代号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
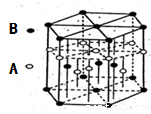
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com