
| A、18O存在于乙酸乙酯中 |
| B、18O存在于水中 |
| C、反应中浓硫酸即是催化剂又是脱水剂 |
| D、若与丙酸反应生成的酯的相对分子质量为104 |
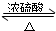 CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故A正确,B错误;
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,故A正确,B错误;

科目:高中化学 来源: 题型:
| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 15 | 20 | 10 | 15 | t1 |
| ② | a | 30 | 0 | 15 | t2 |
| ③ | 15 | b | c | 30 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol?L-1 (NH4)2S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol?L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol?L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol?L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol?L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
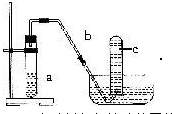
查看答案和解析>>
科目:高中化学 来源: 题型:
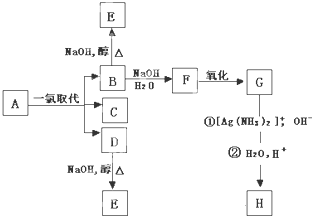
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B的平均消耗速率为0.3mol/(L?min) |
| B、C的平衡浓度为2mol/L |
| C、平衡后,增大压强,平衡将向正方向移动 |
| D、若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(NH3?H2O)c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、H2N(CH2)5COOH |
| C、HO(CH2)5COOH和HO(CH2)5NH2 |
| D、HOOC(CH2)4COOH和H2N(CH2)5NH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com