
| A. | 硝酸银溶液 | B. | 浓硫酸 | C. | 纯碱溶液 | D. | 碱石灰 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+ Ba2+ SiO32- NO3- | |
| B. | 氨气:K+ Na+ AlO2- CO32- | |
| C. | 二氧化硫:Na+ NH4+ SO32- C1- | |
| D. | 甲醛:Ca2+ Mg2+ Mn04- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.06mol.L-1•min-1 | B. | v(H2)=0.04mol.L-1•min-1 | ||
| C. | v(NH3)=0.12mol.L-1•min-1 | D. | v(N2)=0.24mol.L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有相同结构式 | B. | 具有相同分子式 | C. | 具有不同分子量 | D. | 具有不同原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿素CO(NH2)2是一种氮肥 | |
| B. | 储存碳酸氢铵时,应密封并置于阴凉通风处 | |
| C. | 铵态氮肥不能与碱性物质如草木灰等混合施用 | |
| D. | 氮肥溶于水,其中的氮元素均以铵离子形式在存 |
查看答案和解析>>
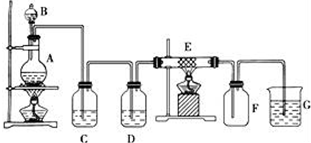
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
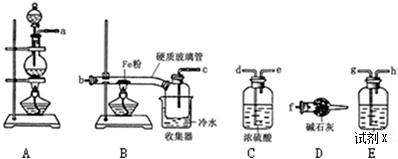
科目:高中化学 来源: 题型:实验题
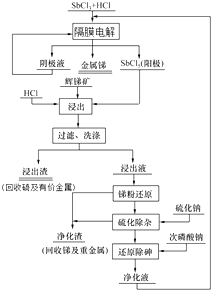
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的中子数为NA | |
| B. | 1molCl2参加氧化还原反应,转移的电子数一定为2NA | |
| C. | T℃时pH=6的纯水中,含有10-6 NA个OH- | |
| D. | 电解精炼铜时,若转移NA个电子,阴极析出32 g铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com