
【题目】常温下向20 mL浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中逐滴加入0.1mol·L-1的Ba(OH)2溶液。充分反应后静置,Ba(OH)2溶液体积与溶液的pH的关系如下图,下列说法正确的是(假设过程中生成的NH3·H2O不分解)
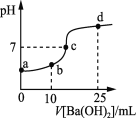
A.a点溶液中:c(NH4+)+c(NH3·H2O)=0.4 mol·L-1
B.b点溶液中:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)
C.c点溶液中:c(Ba2+) + c(NH4+)=c(SO42-)
D.d点溶液中:c(NH3·H2O)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)
【答案】B
【解析】
A、a点溶液是NH4HSO4 、(NH4)2SO4混合溶液,存在物料守恒:c(NH4+)+c(NH3·H2O)=0.3 mol·L-1,故A错误;
B、b点溶液是向20 mL 浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中滴加10mL0.1mol·L-1的Ba(OH)2溶液,则氢离子和氢氧根离子反应完全,铵根离子0.06mol没反应,硫酸根被沉淀了0.01mol,剩余硫酸根是0.03mol,则c(NH4+)>c(SO42-)>c(H+),故B正确;
C、c点溶液是向20 mL 浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中滴加Ba(OH)2溶液,溶液显示中性的时候c(OH-)=c(H+),根据电荷守恒2c(Ba2+) +c(H+)+c(NH4+)=2c(SO42-)+ c(OH-),得到2c(Ba2+) +c(NH4+)=2c(SO42-),故C错误;
D、d点溶液是向20 mL 浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中滴加25mL0.1mol/L的Ba(OH)2溶液,则溶液中产生了0.03molNH3H2O,剩余NH4+0.03mol,剩余SO42-0.015mol,由于溶液呈碱性,电离大于水解,所以c(NH4+)>c(NH3·H2O)>c(SO42-)> c(OH-)>c(H+),故D错误;
故答案B。


科目:高中化学 来源: 题型:
【题目】(15分)“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验。因其有许多优点,近年来被广泛开发并应用于化学实验中。下面这个实验为“套管实验”,实验装置如下图,小试管中部有沾上无水硫酸铜粉末的脱脂棉。请观察实验装置,分析实验原理,并回答下列问题:
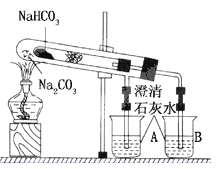
(1)整个实验过程中,能观察到的现象为
①烧杯A中________;②小试管中________;
③烧杯B中____________________________;
(2)实验结束时,在操作上要特别注意的问题是
____________________________________________________________________
(3)写出实验过程中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从电镍含钴废渣(主要成分有Co(OH)3、Ni(OH)3、Fe(OH)3及少量Ca(OH)2、Mg(OH)2等杂质)中提取氧化钴(Co2O3)的工艺流程如下:
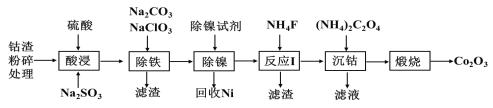
已知:Ksp(CaF2)=3.45×10-11,Ksp(MgF2)=7.42×10-11,Ksp[Co(OH)3]=2×10-44。
(1)在还原剂Na2SO3存在的条件下,钴渣易溶于酸中,请写出酸浸时Co(OH)3与Na2SO3反应的离子方程式______,该步操作中硫酸不宜过量太多的主要原因是 ____。
(2)除铁操作中Fe3+以黄钠铁矾Na2Fe6(SO4)4(OH)12形式从溶液中沉淀析出。中学检验Fe3+的溶液中混有Fe2+的常用试剂是________。
(3)反应Ⅰ中加入NH4F的目的______。
(4)沉钴操作发生的反应为(NH4)2C2O4+CoCl2![]() CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
a.将Na2C2O4溶液与反应Ⅰ滤液同时加入到反应容器中
b.将Na2C2O4溶液缓慢加入到盛有反应Ⅰ滤液的反应容器中
c.将反应Ⅰ滤液缓慢加入到盛有Na2C2O4溶液的反应容器中
(5)450℃在空气中煅烧发生的化学反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4NH3(g)+5O2(g)== 4NO(g)+6H2O(g),该反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的平均速率为 ( )
A. V(O2)=0.01molL-1s-1B. V(NO)=0.008 molL-1s-1
C. V(H2O)=0.003 molL-1s-1D. V(NH3) =0.003 molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
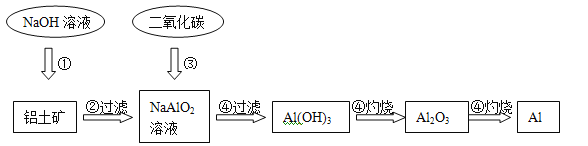
(1)请用离子方程式表示以上工艺流程中第①步反应:__ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:_ _____。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途_____________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
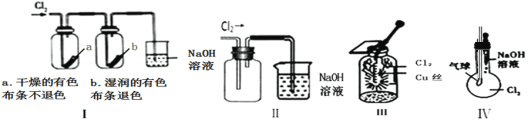
A.图I中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.图II中:收集氯气
C.图IV中:若气球干瘪,证明可与NaOH溶液反应
D.图III中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
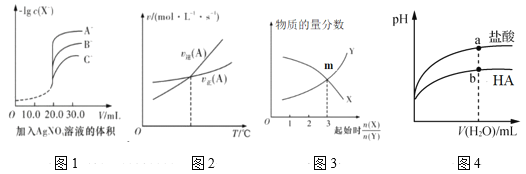
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
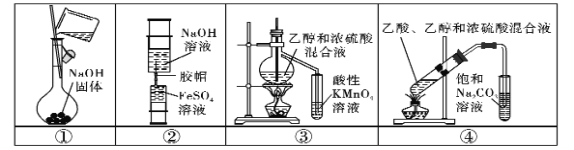
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com