
 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.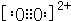 ,1mol B22+中含有的π键数目为2NA.
,1mol B22+中含有的π键数目为2NA. 该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).
该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA). 分析 A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,则A原子有2个电子层,最外层电子数为4,故A为碳元素;C在元素周期表的各元素中电负性最大,则C为氟元素;B原子基态时s电子数与P电子数相等,原子序数小于氟元素,处于第二周期,核外电子排布为1s22s22p4,则B为氧元素;D的基态原子核外有6个能级且全部充满电子,核外电子排布为1s22s22p63s23p64s2,则D为Ca元素;E原子基态时未成对电子数是同周期元素中最多的,其原子外围电子排布为3d54s1,则E为Cr元素;F原子核外最外层电子数与Na相同,其余各层电子均充满,原子核外电子数为2+8+18+1=29,故F为Cu,据此解答.
解答 解:A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,则A原子有2个电子层,最外层电子数为4,故A为碳元素;C在元素周期表的各元素中电负性最大,则C为氟元素;B原子基态时s电子数与P电子数相等,原子序数小于氟元素,处于第二周期,核外电子排布为1s22s22p4,则B为氧元素;D的基态原子核外有6个能级且全部充满电子,核外电子排布为1s22s22p63s23p64s2,则D为Ca元素;E原子基态时未成对电子数是同周期元素中最多的,其原子外围电子排布为3d54s1,则E为Cr元素;F原子核外最外层电子数与Na相同,其余各层电子均充满,原子核外电子数为2+8+18+1=29,故F为Cu.
(1)E为Cr元素,Cr3+的价电子排布式为3d3,故答案为:3d3;
(2)CO32-中C原子的价层电子对数为3+$\frac{4+2-2×3}{2}$=3,C原子孤电子对数为0,CO32-为平面三角形,C原子采取sp2杂化,
故答案为:平面三角形;sp3;
(3)C22-与O22+互为等电子体,离子结构相同,O22+的电子式可表示为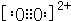 ,1mol O22+中含有的π键数目为2NA,
,1mol O22+中含有的π键数目为2NA,
故答案为: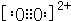 ;2NA;
;2NA;
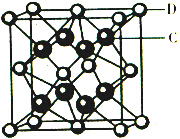
(4)CaF2的电子式为 ,由化合物CaF2的晶胞结构可知,晶胞中含有钙离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有氟离子数目为8,故晶胞的质量为4×$\frac{78}{{N}_{A}}$g,该离子化合协晶体的密度为a g/cm3,则晶胞的体积=$\frac{4×\frac{78}{{N}_{A}}}{ag/c{m}^{3}}$=$\frac{312}{a{N}_{A}}$cm3,
,由化合物CaF2的晶胞结构可知,晶胞中含有钙离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有氟离子数目为8,故晶胞的质量为4×$\frac{78}{{N}_{A}}$g,该离子化合协晶体的密度为a g/cm3,则晶胞的体积=$\frac{4×\frac{78}{{N}_{A}}}{ag/c{m}^{3}}$=$\frac{312}{a{N}_{A}}$cm3,
故答案为: ;$\frac{312}{a{N}_{A}}$.
;$\frac{312}{a{N}_{A}}$.
点评 本题综合查物质结构与性质,推断元素是解题的关键,涉及核外电子排布规律、杂化理论与分子结构、等电子体、晶胞计算等,难度中等,(3)中注意等电子体中价电子总数相等,结构相似,(4)掌握均摊法进行晶胞的有关计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
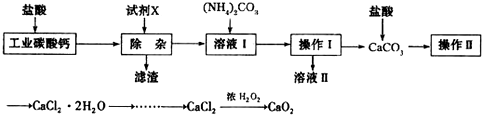
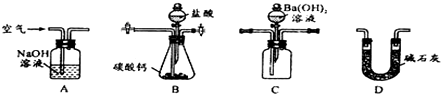
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
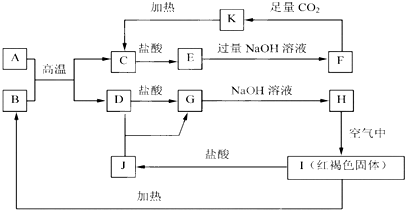
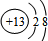 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 石灰水中加入少量小苏打:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
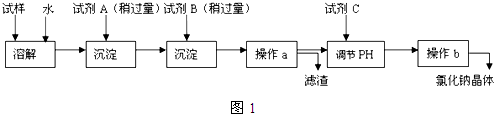
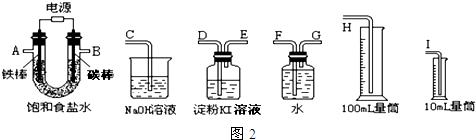
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com