
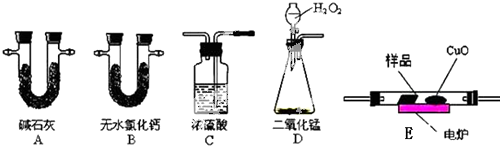
 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:分析 (1)(2)实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入E中的氧气、D用来制取反应所需的氧气、F是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(3)题中该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量,确定物质的化学式可借助元素的质量守恒进行解答;
(4)根据根据元素守恒和质量守恒计算氧原子的物质的量,计算碳、氢、氧原子个数之比,结合相对分子质量计算分子式,根据等效法判断一氯取代产物的数目.
解答 解:(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→E→B→A,
故答案为:DCEBA;
(2)C用于干燥通入E中的氧气,故答案为:除去氧气中的水蒸气;
(3)根据燃烧规律,可以计算产物二氧化碳以及水的质量,进而计算碳原子和氢原子的数目,根据氧元素守恒,可以计算是否含有氧元素以及氧原子的数目,进而得到有机物的最简式,要确定分子式,需要再知道有机物的相对分子质量,故答案为:②;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,所以相对分子质量是44,且它的核磁共振氢谱上有两个峰,即含有两种类型的氢原子,其强度比为3:1,即两种类型的氢原子数目之比是3:1,有机物燃烧后A管增重8.8g,所以产生二氧化碳是0.2mol,B管增重3.6g,所以产生水是0.2mol,根据质量守恒,消耗氧气的质量是:8.8g+3.6g-4.4g=8.0g,即消耗氧气是0.25mol,所以氧原子的物质的量是0.5mol,有机物中含有氧原子的物质的量是0.2mol×2+0.2mol-0.5mol=0.1mol,
所以碳、氢、氧个数之比是2:4:1,相对分子质量是44,含有C、H、O元素且符合条件的有机物是乙醛,结构简式为CH3CHO,与该有机物相对分子质量相同的烃是C3H8,它含有2种等效氢原子,它的一氯代物有2种,故答案为:CH3CHO;2.
点评 本题考查有机物的分子式的实验测定,题目难度中等,关键在于清楚实验的原理,掌握燃烧法利用元素守恒确定实验式的方法.


科目:高中化学 来源: 题型:选择题
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
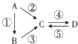 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| D. | 在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的还原性 |
| B | 将氯水加入淀粉KI溶液中 | 验证Cl非金属性比I强 |
| C | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| D | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
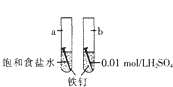
| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com