
【题目】下列不属于配合物的是( )
A. [Cu(H2O)4]SO4·H2O B. [Ag(NH3)2]OH
C. KAl(SO4)2·12H2O D. Na[Al(OH)4]
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是
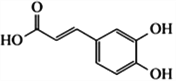
A. 与咖啡酸的官能团完全相同(不含咖啡酸),且苯环上只有3个取代基的同分异构体(不包括顺反异构)有11种
B. 咖啡酸的分子式为C9H6O4
C. 咖啡酸与![]() 互为同系物
互为同系物
D. 1mol 咖啡酸与足量NaHCO3溶液反应产生3mol 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)ΔHl
H2(g)+2O2(g)=H3AsO4(s)ΔHl
H2(g)+![]() O2(g)=H2O(1)ΔH2
O2(g)=H2O(1)ΔH2
As(s)+ ![]() O2(g)=
O2(g)= ![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=_________。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________。
(3)NaH2AsO4溶液呈______(填“酸性”、“中性”或“碱性”),试通过计算说明________________________。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。
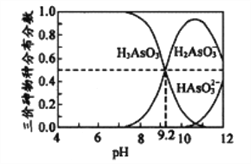
以酚酞为指示剂(变色范围pH8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________。
(5)某化学兴趣小组同学欲探究可逆反应AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
AsO43-+2I-+H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
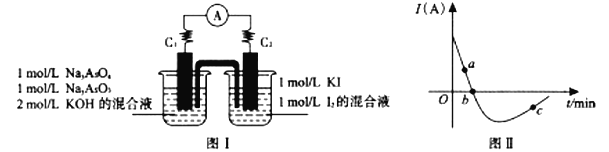
①图II中AsO43-的逆反应速率:a____b(填“>”、”<”或“=”)。
②写出图II中c点对应图I装置的正极反应式__________________________。
③能判断该反应达到平衡状态的是________________。
a.2v(I-)正=v(AsO33-)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
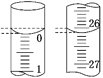
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10﹣8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10﹣5 mol/L。若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A. c(K+)>c(NO3﹣)>c(Ag+)>c(Cl﹣)>c(I﹣)
B. c(K+)>c(NO3﹣)>c(Cl﹣)>c(Ag+)>c(I﹣)
C. c(K+)>c(NO3﹣)>c(Ag+)=c(Cl﹣)+c(I﹣)
D. c(NO3﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

实验一:制备NaClO溶液(实验装置如图1所示)
(1)锥形瓶中发生反应的离子方程式是________________________________________________。
实验二:制取水合肼.(实验装置如图2所示)
已知水合肼具有还原性,被氧化生成氮气。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(2)分液漏斗中的溶液是______(填标号).
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________________________________________________。
实验三:测定馏分中水合肼的质量分数。采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液。
b.移取25.00mL溶液于锥形瓶中,加入10mL水,摇匀。
c.用0.2000 mol·L-1的I2溶液滴定,至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右,记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为:_______________________;
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________。
(5)滴定时,碘的标准溶液盛放在___________(填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00mL,则馏分中水合肼(N2H4·H2O)的质量分数为____________________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是( )
A. 标准状况下,11.2LCO2中含碳氧双键的数目为6.02×1023
B. 30gHCHO被氧化时转移电子数目为4×6.02×1023
C. 反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2+H2O
D. 理论上,吸收HCHO 与消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图给定的仪器组成一套实验装置(各仪器只允许用一次),在室温、 1.01×105 Pa的条件下测定镁的相对原子质量。
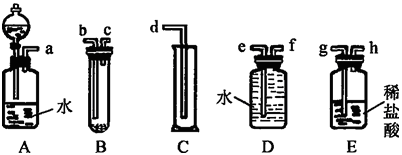
请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为 (用小写字母填写)。
(2)连接好仪器后,要进行的操作有以下几步:
①待仪器B中的物质恢复至室温时,测量量筒 C中水的体积(假定将测定的体积换算成标准状况下为 V mL);
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g,并将其放入试管B中);
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。
(3)根据实验数据可计算出镁的相对原子质量,其数学表达式为 。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(6)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器的规格和名称是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com