
【题目】化合物H是合成巴比妥类镇静药物的中间体,一种以丙烯为原料合成H的路线如下:
![]()
已知:①A、B、C均可发生银镜反应。
②
请回答下列问题:
(1)A的化学名称是___,B中官能团的名称是___。
(2)由C生成D中反应i的化学方程式为___。
(3)E的结构简式为___,由E生成F的反应类型是___。
(4)与H互为同分异构体且与C互为同系物的有机物有___种,其中核磁共振氢谱有3组峰的结构简式为___(任写一种)。
(5)设计由乙烯、乙醇钠和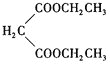 为原料制备2-乙基丁酸的合成路线
为原料制备2-乙基丁酸的合成路线![]() 无机试剂任选
无机试剂任选![]() ___。
___。
【答案】丙烯醛 醛基、羟基 OHC-CH2-CHO+4Ag(NH3)2OH![]() H4NOOC-CH2-COONH4+4Ag↓+6NH3+2H2O
H4NOOC-CH2-COONH4+4Ag↓+6NH3+2H2O  取代反应 9 OHC(CH2)4CHO或
取代反应 9 OHC(CH2)4CHO或![]()

【解析】
丙烯被氧化为A,A分子式是C3H4O,可发生银镜反应,所以A是CH2=CH-CHO;CH2=CH-CHO与水发生反应生成B, B相对分子质量是74,B可发生银镜反应,能发生催化氧化生成C,C发生银镜反应生成D,D 与乙醇反应生成E,E分子中含有7个碳原子,所以D分子中含有2个羧基,逆推可知D是HOOCCH2CHOOH、C是OHCCH2CHO,B是HOCH2CH2CHO;E是C2H5OOCCH2COOC2H5,C2H5OOCCH2COOC2H5与![]() 发生取代反应生成
发生取代反应生成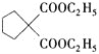 ;
; 水解为G,G是
水解为G,G是 ,
, 脱掉1个CO2生成H,H是
脱掉1个CO2生成H,H是![]() 。
。
根据以上分析, ![]() 为
为![]() ,名称是丙烯醛;B为
,名称是丙烯醛;B为![]() ,官能团的名称为羟基和醛基;
,官能团的名称为羟基和醛基;
![]() 为
为![]() ,D为
,D为![]() ,由C生成D中反应i的化学方程式为OHC-CH2-CHO+4Ag(NH3)2OH
,由C生成D中反应i的化学方程式为OHC-CH2-CHO+4Ag(NH3)2OH![]() H4NOOC-CH2-COONH4+4Ag↓+6NH3+2H2O;
H4NOOC-CH2-COONH4+4Ag↓+6NH3+2H2O;
![]() 的结构简式为
的结构简式为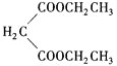 ,由E生成F可视为E分子“
,由E生成F可视为E分子“![]() ”中的两个H与
”中的两个H与![]() 中的溴原子发生取代反应生成
中的溴原子发生取代反应生成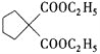 和HBr,反应类型是取代反应;
和HBr,反应类型是取代反应;
![]() 的分子式为
的分子式为![]() ,C为
,C为![]() ,故与H互为同分异构体且与C互为同系物的有机物含有2个醛基。若剩余4个碳原子的连接方式为
,故与H互为同分异构体且与C互为同系物的有机物含有2个醛基。若剩余4个碳原子的连接方式为![]() ,2个醛基连接在
,2个醛基连接在![]() 上的结构有6种,若剩余4个碳原子的连接方式为
上的结构有6种,若剩余4个碳原子的连接方式为![]() ,2个醛基连接在
,2个醛基连接在![]() 上的结构有3种,共9种,其中核磁共振氢谱有3组峰的结构简式为
上的结构有3种,共9种,其中核磁共振氢谱有3组峰的结构简式为![]() 或
或![]() ;
;
![]() 乙烯与溴化氢发生加成反应生成溴乙烷,溴乙烷与
乙烯与溴化氢发生加成反应生成溴乙烷,溴乙烷与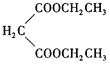 发生取代反应生成
发生取代反应生成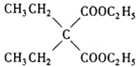 ,
, 在酸性条件下水解为
在酸性条件下水解为 ,
, 在加热条件下脱掉1分子CO2生成
在加热条件下脱掉1分子CO2生成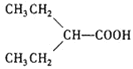 ,合成路线为
,合成路线为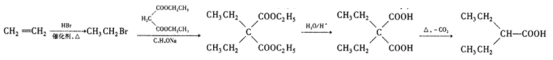 。
。


科目:高中化学 来源: 题型:
【题目】某气态烃0.5mol能与0.5molCl2完全加成,加成产物又可被3molCl2完全取代,则此气态烃可能是
A.CH2=CH2B.CH3-CH=CH2
C.CH2=CHCH2CH3D.CH2=CH-CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量稀硫酸(不考虑反应过程中硫酸浓度的变化)中加入一定量的锌粒,同时不断向其中滴加硫酸铜溶液,观察到生成氢气的速率如图所示。下列有关说法错误的是( )
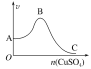
A.AB段速率的变化可能是因为溶液温度逐渐升高
B.AB段速率的变化可能是因为形成了铜锌原电池
C.BC段速率的变化可能是因为溶液温度逐渐降低
D.BC段速率变化的原因主要是置换出的铜太多,覆盖在锌粒表面,阻碍了反应的进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是( )

A.正反应的活化能等于逆反应的活化能
B.a曲线是加入催化剂时的能量变化曲线
C.1moN2与3moH2充分反应放出的热量小于92kJ
D.增大压强,可以提高反应物活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
①与氯元素同族的短周期元素的原子结构示意图为______。
②能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是____。
a. Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c. HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
③设计一个实验方案,证明氧化性Cl2>Br2:___________。
(2)铅是碳的同族元素,比碳多4个电子层。
①铅在元素周期表的位置为_______。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________________。
②反应器内NH3还原NO2过程中,若还原产物比氧化产物少1mol,转移电子总数__________个(用NA表示)。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成_______________________________________________。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。

① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:________________________ ______15NNO+ ________H2O
______15NNO+ ________H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同一物质在气态时的能量大于在液态时的能量。一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______(填“大于”“小于”或“等于”)Q2。
(2)已知:4HCl+O2=2Cl2+2H2O,该反应中,4molHCl被氧化,放出115.6kJ的热量,则断开1molH—O键与断开1molH—Cl键所需能量相差约为______kJ。

(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图:
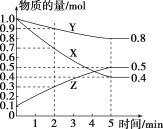
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率之比为3:1
C.容器内气体的压强保持不变
D.容器内气体的总质量保持不变
③0~2min内Y的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年在一些国家的某些食品中“二恶英”含量严重超标,一时间掀起了席卷欧洲的“二恶英”恐慌症。“二恶英”是二苯基-1,4-二氧六环及其衍生物的通称,其中一种毒性最大的结构是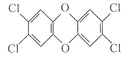 ,关于这种物质的叙述中不正确的是
,关于这种物质的叙述中不正确的是
A.该物质是一种芳香族化合物
B.该物质是一种卤代烃
C.该物质是一种强烈致癌物
D.该物质分子中所有原子可能处在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com