
【题目】现有73gHCl气体,计算:
(1)该气体为___ mol。
(2)该气体所含分子数为_________个。
(3)该气体在标准状况下的体积为___ L。
(4)将该气体溶于水配成2L溶液,其物质的量浓度为_______mol/L
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。

请按要求回答下列问题:
(1)元素⑦的原子结构示意图______________________。①、④按原子个数比为1:1组成的分子的电子式____________________;由②、④两种元素组成的一种化合物的结构式________________;
(2)⑤⑥两种元素的原子半径由大到小的顺序是____________(填元素符号)。
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是________(填化学式)。
(4)元素③的气态氢化物和元素⑧的气态氢化物易于制备的是___________(填化学式)。
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为_________________________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式__________________ ;一种离子化合物的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②的名称为___________,该操作所用到的玻璃仪器主要有______。
(2)固体A为____________;
(3)写出加入原料①和②有关反应的离子方程式__________________、________________________。
(4)操作③获得FeSO4·7H2O,需要经过_____、_____、过滤等操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月,中国对“可燃冰”试采成功。“可燃冰”是天然气水合物,被称为未来新能源。回答下列问题:
(1)用Cu2Al2O4作催化剂制备乙酸
已知:![]() ,各物质相对能量大小如图。
,各物质相对能量大小如图。
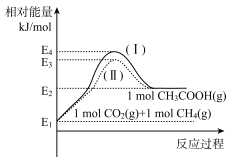
①a=____。
②反应物的活化分子浓度大小:过程I___ 过程Ⅱ(填“大于”、“小于”或“等于”)。
(2)甲烷超干催化重整(DRM)制备CO,在Ni、CaO及Fe3O4的共同催化作用下,可以获得极高浓度的CO,其机理如下:
第①步:Ni基催化![]()
第②步:Fe的还原![]()
第③步:CO2的捕获![]()
第④步:CO2的释放与还原![]()
设计第②步与第③步反应有利于实现氢物种与____的彻底分离,从勒夏特列原理的角度看,这也有利于____;过程①中,当投料比![]() = ___时,才能保持催化剂组成不变。
= ___时,才能保持催化剂组成不变。
(3)甲烷催化重整与压强的关系
已知:![]() ,现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2)的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是 ___(填番号);求该温度条件下反应的平衡常数Kp=___ (计算表达式)。【已知:Kp是用分压力代替各物质的浓度计算的平衡常数,任一组分B的分压p(B)等于总压p乘以它的体积分数y(B)】
,现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2)的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是 ___(填番号);求该温度条件下反应的平衡常数Kp=___ (计算表达式)。【已知:Kp是用分压力代替各物质的浓度计算的平衡常数,任一组分B的分压p(B)等于总压p乘以它的体积分数y(B)】
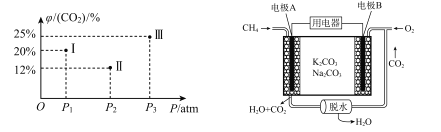
(4)甲烷用于燃料电池
已知:甲烷电池的工作原理如上有图,则负极反应方程式为 ___;当A极消耗标况下44.8 LCH4时,理论上B极转移电子的物质的量为 ___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com