
| A. | HF、HCl、HBr、HI的熔、沸点依次升高 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | CO2、SO2都是极性分子 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
分析 A.HF分子间可形成氢键,沸点较高;
B.形成配位键,应分别提供孤对电子和空轨道;
C.SO2是极性分子,CO2分子是非极性分子;
D.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强.
解答 解:A.由于F的非金属性较强,对饮的氢化物HF分子间可形成氢键,沸点较高,故A错误;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键,故B正确;
C.CO2、SO2中心原子的杂化方式不同,二氧化碳为直线形分子,二氧化硫为V形,SO2是极性分子,CO2分子是非极性分子,所以二者分子的极性不同,故C错误;
D.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,则酸性HClO4>HClO3>HClO2>HClO,故D错误.
故选B.
点评 本题考查较为综合,涉及共价键、氢键、配位键和酸性的比较,为高考常见题型,综合考查学生的分析能力和化学科学素养,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
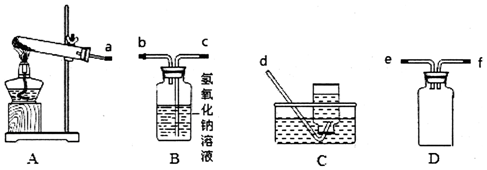
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过化学变化可以实现16O与18O之间的转化 | |
| B. | 因为H2O的沸点高于H2S,所以O原子得电子能力大于S原子 | |
| C. | 某化合物熔融状态下能导电,该化合物中一定有离子键 | |
| D. | 化学键是相邻分子之间的强烈的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②③⑤⑦ | C. | ②③⑥⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
| E | 基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297.23 kJ/mol | |
| B. | 形成1 mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ | |
| D. | 1mol SO2的总能量小于 1mol S(s)和1mol O2(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
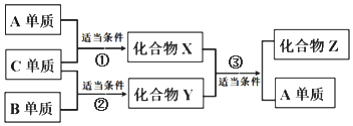 原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族且只有一种金属,D的单质可与热水发生置换反应,所得溶液只能使酚酞变为浅红色;X、Y、Z是由A、B、C组成的二元化合物,其中X常温为液体,且Z可用于配制碳酸饮料.它们之间有如下转化关系,(①②条件为点燃,③为高温、催化剂)下列说法不正确的是( )
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族且只有一种金属,D的单质可与热水发生置换反应,所得溶液只能使酚酞变为浅红色;X、Y、Z是由A、B、C组成的二元化合物,其中X常温为液体,且Z可用于配制碳酸饮料.它们之间有如下转化关系,(①②条件为点燃,③为高温、催化剂)下列说法不正确的是( )| A. | D单质着火不可以用泡沫灭火器灭火 | |
| B. | 化合物Y和Z均为空气质量日报的主要污染物 | |
| C. | 原予半径:D>B>C>A | |
| D. | 化合物W化学式为B2A4,在一定条件下W可以与X发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 在标况下,22.4LHF和22.4LC2H4原子个数比为1:3 | |
| C. | 6.0gSiO2晶体中含有0.4NA个Si-O键 | |
| D. | 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com