
| A、硫酸铝与过量的氨水反应:Al3++4OH-═AlO2-+2H2O | ||||
| B、除去铁粉中的铝:2Al+2NaOH═2NaAlO2+H2↑ | ||||
C、实验室制取Cl2的离子方程式:MnO2+4HCl(浓)
| ||||
D、浓硫酸与铜的反应:Cu+2H2SO4(浓)
|
| ||
| ||


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:

| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,体系的颜色变浅 |
| B、保持温度和容器体积不变,再充入1moLNO2气体,当达到新平衡时NO2的体积分数将增大 |
| C、保持温度和容器体积不变,再充入0.5moLN2O4气体,当达到新平衡时N2O4的体积分数将增大 |
| D、若保持温度不变,压缩容器的体积,达到新平衡时混合气体的颜色变浅,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| C、0.012kg(金刚石)中含有c-c键数目为2NA |
| D、常温常压下,1.7g H2O2中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42- |
| B、加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、HCO3- |
| C、水电离产生的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D、0.1mol?L-1HNO3溶液中:Mg2+、NH4+、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+SO32- |
| C、用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| D、向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2013年0点钟声敲响后的几个小时,北京的污染指数从轻度污染上升为重度污染,主要污染为PM2.5污染,看来烟花爆竹的燃放,可加重PM2.5污染 |
| B、催化剂之所以能加快反应速率,是因为催化剂能降低反应的活化能 |
| C、氨气的水溶液氨水可以导电,因此氨气是电解质 |
| D、大量燃烧含硫燃料是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、360mg |
| B、3.6g |
| C、0.36g |
| D、2.5×10-4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
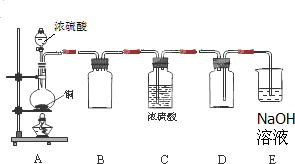 Na2SO3、SO2是中学常见的物质.
Na2SO3、SO2是中学常见的物质.| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | |
| 步骤② | 在试管B中加入少量待测液, |
有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴 |
证明待测液中含SO32-. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com