
��14�֣��о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1����֪��2SO2(g)+O2(g) 2SO3(g) ��H= -196.6kJ��mol-1
2SO3(g) ��H= -196.6kJ��mol-1
2NO(g)+O2(g) 2NO2(g) ��H= -113.0kJ��mol-1
2NO2(g) ��H= -113.0kJ��mol-1
��ӦNO2(g)+SO2(g) SO3(g)+NO(g)�Ħ�H= kJ��mol-1��
SO3(g)+NO(g)�Ħ�H= kJ��mol-1��
һ�������£���NO2��SO2�������2��1�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
A����ϵѹǿ���ֲ��� B�����������ɫ���ֲ���
C��SO3��NO������ȱ��ֲ��� D��ÿ����1molSO3��ͬʱ����1mol NO
���������Ӧ��ƽ��ʱNO2��SO2�������Ϊ5��1����ƽ�ⳣ��K= ��
��2��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g) CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��2����ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250�桢
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��2����ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250�桢
1.3��104kPa���ң�ѡ���ѹǿ�������ǣ� ��

��3������ȼ�յķ�Ӧԭ�����ϳɵļ״����������ͼ��3����ʾ��ԭ���װ�á�
�� �õ�ع���ʱ��OH-�� ���ƶ����������������
�� �õ�������ĵ缫��ӦʽΪ ��
��1��-41.8��BD��1.8��
��2��������1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ��
��3�������� O2+2H2O+4e-=4OH-��
��������
���������
��1�����ݸ�˹���ɣ����ڶ�������ʽ��д�����һ������ʽ��ӵã�2NO2(g)+2SO2(g) 2SO3(g)+2NO(g)
2SO3(g)+2NO(g)
��H=-83.6 kJmol-1����NO2(g)+SO2(g)  SO3(g)+NO(g) ��H=-41.8 kJmol-1��
SO3(g)+NO(g) ��H=-41.8 kJmol-1��
A������Ӧ�Ƿ�Ӧǰ���������������ķ�Ӧ������ϵ��ѹǿ���ֲ��䣬��A����˵����Ӧ�Ѵﵽƽ��״̬��
B�����ŷ�Ӧ�Ľ��У�NO2��Ũ�ȼ�С����ɫ��dz����B����˵����Ӧ�Ѵ�ƽ�⣻
C��SO3��NO�����������������1��1����C������Ϊƽ��״̬���ж����ݣ�
D������1molSO3Ϊ����Ӧ��ͬʱ����1mol NOΪ����Ӧ�������㻯ѧ������֮�ȣ�˵�����淴Ӧ������ȣ���D����Ϊƽ��״̬���ж����ݡ�
NO2(g)+SO2(g)  SO3(g)+NO(g)
SO3(g)+NO(g)
��ʼ���ʵ���� 2a a 0 0
ת�����ʵ���� x x x x
ƽ�����ʵ���� 2a-x a-x x x
ƽ��ʱNO2(g)��SO2(g)�������Ϊ5��1������������ʽ֪����2a-x������a-x����5��1����x�� ����ƽ�ⳣ��K��
����ƽ�ⳣ��K�� ��
��
��2����ͼ��֪���¶����ߣ�CO��ת���ʽ��ͣ�ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ������Ӧ�Ƿ��ȷ�Ӧ����H��0��ѹǿ�������ڼӿ췴Ӧ���ʣ�������ʹƽ�������ƶ�����ѹǿ������Ҫ�Ķ������豸��Ҫ��Ҳ�ߣ���ѡ��250�桢1.3��104kPa���ҵ���������Ϊ��250�桢ѹǿΪ1.3��104 kPaʱ��CO��ת�����ѽϴ�������ѹǿ��CO��ת���ʱ仯����û�б�Ҫ������ѹǿ��
��3���ٸ���ԭ��صĹ���ԭ�������������ƶ�������OH-���ƶ���
�ڵ������ҺΪ������Һ������������ӦΪ��O2+2H2O+4e-=4OH-��
����:�����˹���ɵ�Ӧ�ã��Ȼ�ѧ����ʽ����д����ѧƽ���־�жϣ�ԭ���ԭ��Ӧ��
����:���⿼���˸�˹���ɵ�Ӧ�ã��Ȼ�ѧ����ʽ����д����ѧƽ���־�жϣ�ԭ���ԭ����Ӧ�ã��Ѷ��еȡ����⽫Ԫ�ػ�����֪ʶ�������仯����ѧƽ���֪ʶ�����һ���ۺ��Խ�ǿ����Ҫϸϸ����������ͻ�ơ��״����ǣ�2����Ҫ�������ͼ�ó���ȷ���ۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�����ж�������һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����غ��������Ļ����Һ�У�Al3����Ũ��Ϊ0.4 mol/L�� ��Ũ��Ϊ0.7 mol/L����K�������ʵ���Ũ��Ϊ
��Ũ��Ϊ0.7 mol/L����K�������ʵ���Ũ��Ϊ
A��0.1 mo/L B��0.15 mol/L C��0.2 mol/L D��0.3 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ��ƶ���
(8��)�����ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz������������ֽ�������A��B��C��������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û�б������

��1��д���������ʵĻ�ѧʽ��F�е����� _________����____________��
��2����Ӧ�۵����ӷ���ʽ__________________
��3��H���ȷֽ��Ĺ�����������B�����µĻ�ѧ����ʽ��_______________________
��4��A��ˮ��Ӧ�����ӷ���ʽ__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����������������Һ���ܴ����������
A��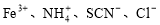 B��
B��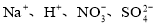
C��Al3����Fe2+��NO3-��Cl�� D��K����Na����Cl����SiO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������������ʢ�ŵ���
A��ϡ���� B������������Һ C��Ũ���� D������ͭ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������и߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڵ������Һ����������ȷ����
A�������£�pH=7��CH3COONa��CH3COOH�Ļ����Һ������Ũ�ȴ�С˳��Ϊc(Na+)=c(CH3COO-)��c(H��)= c(OH-)
B����pH=10�İ�ˮϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
C���к�pH���������ͬ������ʹ�����Һ������NaOH�����ʵ���ǰ��С�ں���
D�������£�ͬŨ�ȵ�Na2CO3��Һ��NaHCO3��Һ��ȣ�Na2CO3��Һ��pH�ϴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������и߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A���ɱ�����Ҫ���մ������ȣ�����ǻ�ѧ��Ӧ�е����ȷ�Ӧ
B�������ڼ��Ȼ��ȼ�����½��еķ�Ӧ�������ȷ�Ӧ
C�������������溸�ӻ��и��������Ҫ����������������������ʱ���ų�������
D�������о�ˮ���ã���������������Ӳˮ������ʹӲˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���з�̨��������һѧ����ĩ��ϰ��ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ����Ӧ�ķ���ʽ����ȷ����
A����Na2S��ȥ��ˮ�е�Hg2+��Hg2+ +S2- === HgS
B��������Һ����ϴ���ۣ�
C���������Ȼ���ʱ�������̣�
D�����ҽ���Һ�м������ᡢ˫��ˮ��2I- +2H+ +H2O2=== I2 +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A��0.1mol/L�������Һ�и����ӵ�Ũ���ɴ�С��˳���ǣ�c (NH4+)>c(SO42��)>c(H+)>c(OH��)
B�����մ���С�մ�Ļ����Һ�д��ڣ�c(Na+)+c(H+) =c(OH -)+2c(CO32-)+c(HCO3-)
C���ڵ��з�̪��Na2CO3��Һ�У�����BaCl2��Һ���ɫ��ȥ��֤��Na2CO3��Һ�д���ˮ��ƽ��
D�����³�ѹ�����Է����еķ�Ӧ��һ�����Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com