

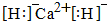 .
.| 19.6 |
| 80% |
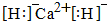 故答案为:
故答案为: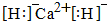 .
.

科目:高中化学 来源: 题型:
 如图为《化学1》中所学“氯碱工业”制取氯气的示意图,下列有关说法错误的是( )
如图为《化学1》中所学“氯碱工业”制取氯气的示意图,下列有关说法错误的是( )| A、这是电解原理的实际应用 | ||||
| B、铁棒为阴极,石墨棒为阳极 | ||||
C、电解方程式为2NaCl
| ||||
| D、在铁棒一侧的溶液里滴加酚酞试液,溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1-18纵列中的第10、12纵列元素.请回答下列问题:
已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1-18纵列中的第10、12纵列元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3 OH | 2mol CH3OH | |
| 平衡时 数据 | 反应能量变 化的绝对值(kJ) | a | b | c |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | p2 | p3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸性溶液中:Mg2+、K+、SO42-、NO3- |
| B、强碱性溶液中:Na+、Cu2+、HCO3-、NO3- |
| C、0.1 mol?L-1AgNO3 溶液中:H+、K+、SO42-、Cl- |
| D、0.1 mol?L-1Ba(NO3)2 溶液:Mg2+、K+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com