
下列有关说法正确的是
A.马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀
B.CH3Cl(g)+Cl2(g)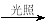 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS)
D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:2014-2015学年浙江省高三第一次五校联考化学试卷(解析版) 题型:选择题
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号 | 甲 | 乙 | 丙 |
① | CO2 | SO2 | 石灰水 |
② | HCl | CO2 | 石灰水 |
③ | CO2 | SO2 | Ba(NO3)2 |
④ | NO2 | SO2 | BaCl2 |
⑤ | CO2 | NH3 | CaCl2 |
A.②③④ B.②③④⑤ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA
B.标准状况下,2.24 LNO2 与水反应生成NO3-的数目为0.1NA
C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大。金属W是制备手机电池的常用材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是它的电子层数的2倍。下列说法正确的是
A.W的金属性是同主族元素中最强的
B.X、Z形成的化合物为离子化合物
C.X最高价氧化物对应水化物的酸性大于Z的最高价氧化物对应水化物的酸性
D.原子半径Y>Z,离子半径Y3+< Z 2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:填空题
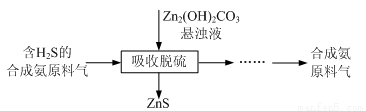
(12分)实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。

(1)“酸浸”时保持H2SO4过量的目的是 。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式: 。
②流程中调节pH=5.4所加试剂X为 (填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由 。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol溴苯中含有双键的数目为0.3NA
B.0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA
C.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA
D.标准状况下,11.2L 由H2和CO组成的混合气体中含有分子的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了 ,B元素位于周期表五个区域中的 区。

②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4—中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
③写出一种与 CN—互为等电子体的单质分子式 。
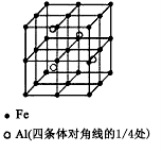
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去的离子有______、_______。
②盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③过程VI中,产品NaOH在电解槽的______区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:选择题
下列描述正确的是
A.常温下,pH=7的NH4Cl与NH3·H2O混合溶液中,c(NH4+)=c(Cl_)
B.可用NaOH溶液除去MgCl2溶液中少量的FeCl3
C.足量铁粉与稀硝酸反应:Fe+4H++NO3- =Fe3++2H2O+NO↑
D.向某溶液滴加盐酸酸化的氯化钡溶液,出现白色沉淀,则证明该溶液中含有SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com