
| A. | O.lmol过氧化钠中,阴阳离子总数为0.4 NA | |
| B. | 11.2L氯气通入足量的NaOH充分反应,转移的电子数目为0.5 NA | |
| C. | 17g NH3气体含σ键的数目为3NA | |
| D. | 1L O.lmol/L氨水中,OH-数目为0.1 NA |
分析 A.过氧化钠中阴离子为过氧根离子;
B.气体状况未知;
C.1个氨气分子含有3个N-H键;
D.氨水为弱碱,一水合氨在溶液中只能部分电离;
解答 解:A.lmol过氧化钠中,含有阳离子0.2mol,阴离子0.1mol,阴阳离子总数为0.3NA,故A错误;
B.气体状况未知,无法确定氯气的物质的量,故B错误;
C.17g NH3气体物质的量为1mol,含σ键的数目为3NA,故C正确;
D.lL 0.lmol•L-1的氨水中含有溶质0.1mol,由于一水合氨为弱电解质,溶液中只能部分电离,所以溶液中氢氧根离子的物质的量小于0.1mol,OH-离子数目小于0.1N,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化关系是解题关键,注意气体摩尔体积使用条件和对象,注意弱电解质部分电离,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素中没有非金属元素 | |
| B. | 碱金属元素是指ⅠA族的所有元素 | |
| C. | 除第1周期外,其他周期均有18种元素 | |
| D. | 7个横行代表7个周期,18个纵行代表18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 事实 | 原因 | |
| A | 稀有气体的晶体属于原子晶体 | 其组成微粒是原子 |
| B | 键的极性H-O>H-S | 氧的电负性强于S的电负性 |
| C | HF稳定性比HI强 | HF分子间能形成氢键而HI不能 |
| D | 金刚石的熔沸点高于晶体硅 | C-C键能大于Si-Si键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素族序数一定等于它的最外层电子数 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
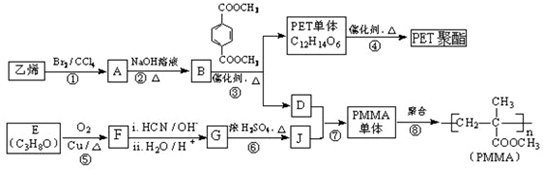
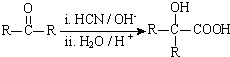 (R、R′代表烃基)
(R、R′代表烃基)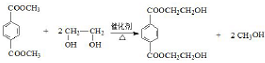 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com