
����װ�г��������������Ϊ��ԭ�����ۡ��Ȼ��ơ�̿�۵ȣ�������ԭ���������������ʴ��ͬ�����з�����ȷ���� �� ��
A���������������ȷ�Ӧ���ɽ����¶ȣ��ӳ���㱣����
B����������������ԭ����������缫��ӦΪ��Fe-2e��=Fe2+
C������������̼��ԭ��ظ������缫��ӦΪ��2H2O+O2+4e��=4OH��
D������1.12g���۵����������������������������336mL����״����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ������ʵ����������ͿƼ��ȷ����Ӧ�ò���ȷ����(����)
A���ⶨNaOH�۵�ʱ�����Խ�NaOH����ʯӢ�����и��¼���
B��ʯӢɰ����������ȡ�ߴ��ȵĹ裬���ǽ�̫����ת��Ϊ���ܵij��ò���
C����Ϊ����Һ����Һ��������ʱ�����մ���������������Һ�����������
D����������ᶼ����Ҫ�Ĺ�ҵԭ�ϣ���ҵ�Ͽ������ƻ��ʡ�ũҩ��ըҩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ʢ������ͭˮ��Һ���Թ�����백ˮ�������γ�������������Ӱ�ˮ���������ܽ�õ�����ɫ������Һ�����жԴ�����˵����ȷ���� ( )
A����Ӧ����Һ�в������κγ��������Է�Ӧǰ��Cu2+��Ũ�Ȳ���
B��������ͭ��Һ��������ͭ��Һ����ʵ�飬���ܹ۲쵽ͬ��������
C�������ܽ����������ɫ���������[Cu��NH3��4]
D����[Cu��NH3��4] 2+�����У�Cu2+�����¶Ե��ӣ�NH3�ṩ�չ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1) ��֪��0.4 molҺ̬��(N2H4)��������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.65 kJ��������
�ٷ�Ӧ���Ȼ�ѧ����ʽΪ��____________________________________________.
�ڴ˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ���______________________________________________________________��
(2)����ȼ�տ���ͨ����������;����
;����C3H8(g)��5O2(g)===3CO2(g)��4H2O(l) ��H����a kJ/mol
;����C3H8(g)===C3H6(g)��H2(g) ��H����b kJ/mol
2C3H6(g)��9O2(g)===6CO2(g)��6H2O(l) ��H����c kJ/mol
2H2(g)��O2(g)===2H2O(l) ��H����d kJ/mol
��ش��������⣺
�ٵ����ı���ͨ������;���ų���������;����ų�������________(����ڡ��������ڡ���С�ڡ�);����ų���������
��C3H8(g)===C3H6(g)��H2(g)�ķ�Ӧ�У���Ӧ����е�������________(����ڡ��������ڡ���С�ڡ�)��������е�����������
��b��a��c��d����ѧ��ϵʽ��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���� (���� )
A����ӦAlCl3��4NaOH===NaAlO2��3NaCl��2H2O��������Ƴ�ԭ���
B��Zn��ϡ���ᷴӦʱ����������CuSO4��Һ�ܼӿ����H2������
C����FeƬ��CuƬ����ϡ�����У����õ��߰Ѷ����������۲쵽CuƬ�ϲ����������ݣ�˵��Cu��H2SO4�ܷ�����Ӧ��Fe���ۻ�
D�������Ʋ������п���ȶ��������ױ���ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
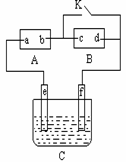
����ͼ,AΪֱ����Դ��c��d��Ϊʯī�缫��BΪ�������Ȼ�����Һ�ͷ�̪��Һ����ֽ��CΪ��Ʋۣ���ͨ��·����B�ϵ�c���Ժ�ɫ������գ�
��1����ԴA�ϵ�aΪ________����
��2����ֽB�Ϸ������ܻ�ѧ����ʽΪ___________________��
��3�����ڵ�Ʋ���ʵ�����϶�п���պ�K����ʹc��d�����·����缫e�Ϸ����ķ�ӦΪ ���缫f�Ϸ����ķ�ӦΪ______________________________�����зŵĵ��Һ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ����д��ȷ���ǣ� ��
A. �������ռ���Һ��Ӧ��Al��6OH��= [Al(OH)4]����H2��
B. ˮ�����м���ϡ���Na2SiO3+2H+=H2SiO3��+2Na+
C. �����������������Һ��Ӧ��SiO2+2OH��=SiO32-+H2O
D. ���Ȼ�����Һ�еμӹ����İ�ˮ��Al3����4OH����[Al (OH)4]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.1mol��þ�������������100ml 4mol/L�������У�Ȼ��μ�NaOH��Һ���ڵμ�NaOH��Һ�����У�����������m�����NaOH��Һ�����V�仯�Ĺ�ϵ��ͼ��ʾ��
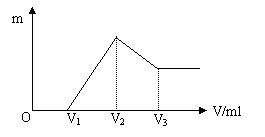
��1����д��ÿ���η�����Ӧ�����ӷ���ʽ��
OV1�Σ�
V1V2�Σ�
V2V3�Σ�
��2���ڵμ�NaOH�Ĺ����У���V2=400ml�������NaOH��Һ��Ũ��Ϊ mol/L��
��3���μ�����Ũ�ȵ�NaOHʱ����V1=160ml���������ĩ��n(Mg)= mol��
n(Al)= mol�� V3= ml��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ���������ֵ������˵����ȷ����(����)
A�����³�ѹ�£�16 g�����ͳ����Ļ�����к���NA����ԭ��
B����״���£�11.2 L H2O�к�������Ϊ0.5NA
C����״���£�22.4 L H2�к�������ΪNA
D��100 mL 0.1 mol��L��1��AlCl3��Һ��Al3���ĸ���Ϊ0.01NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com