
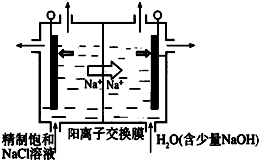
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺分析 ①阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子;
②在阴极发生反应:2H++2e-=H2↑,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,通过阳离子交换膜的阳离子为+1价离子,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O?OH-+H+的平衡向右移动.
解答 解:①阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子,阳极电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大.
点评 本题考查电解原理应用及有关计算等,关键是明确电极发生反应,理解电解工作原理,注意电子转移守恒在电化学计算中应用.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物休内的叶绿素非常相似。下列说法中不正确的是 ( )
A.“钴酞菁”分子所形成的分散系不具有丁达尔效应
B.“钴酞菁”分子能透过滤纸
C.此项工作可以用来改变分子的某些物理性质
D.此项工作可广泛应用于光电器件、生物技术等方面
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于α | B. | 大于α | C. | 小于α | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙提高相同温度 | B. | 甲中加入1molHe,乙不变 | ||
| C. | 甲降低温度,乙不变 | D. | 甲增加1molH2,乙增加1molI2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  所示的总反应为吸热反应 | |
| B. |  可表示3A(g)?2B(g)+C(s)受不同压强的影响,且乙的压强比甲的压强大 | |
| C. |  所示实验为用0.01mol•L-1的HCl溶液滴定20mL 0.01mol•L-1的NaOH溶液 | |
| D. |  依据,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH约为4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
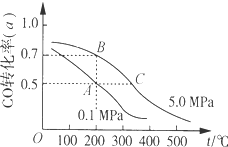
| A. | A、B两点表示在某时刻达到平衡状态,此时A、B两点时容器中,n(A)总:n(B)总=4:5 | |
| B. | 在A点时保持恒温恒容,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) | |
| C. | 若开始时向容器中充入1mol CO与2mol H2,达到平衡(与A点相同温度压强)时,CO的 转化率小于50% | |
| D. | 在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4?2H++SO42- | B. | BaCl2═Ba2++2Cl- | ||
| C. | NH3•H2O═NH4++OH- | D. | Na2CO3═Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 化学反应的焓变与反应的途径有关 | |
| D. | 等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com