
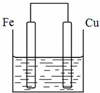
 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).

科目:高中化学 来源: 题型:
| A、产物B的状态可能为气态、固态或液态 |
| B、平衡时,单位时间内m(A)消耗﹕m(C)消耗=1﹕1 |
| C、保持体积不变,向平衡体系中加入B,平衡可能不移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 |
 |
 |
 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
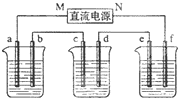 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重金属污染物,如汞、镉、铅、铬等对水体能造成污染,必须经过处理后才可排放 |
| B、生活污水中所含的氮、磷化合物是植物营养素,过多排放会引起赤潮、水华等 |
| C、向煤中加入适量石灰石,发生反应2CaCO3+O2+2SO2═2CaSO4+2CO2,可大大减少燃烧产物中SO2的量 |
| D、所有白色物质(如:白纸、白面、白布等)遗留在自然界都能引起白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、达到平衡时,再充入1mol X,该反应的Q变大 |
| B、用Y表示4min内的反应速率为0.1mol/(L?min) |
| C、再向容器中充入1molZ,达到新平衡,反应速率v(X):v(Y)=2:1 |
| D、4min后,若升高温度,平衡将向逆反应方向移动,平衡常数K减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com