
某研究性学习小组查阅资料知:O2在酸性环境中氧化性明显增强,为了探究过氧化钠的强氧化性,设计了如图的实验装置。实验步骤及现象如下:
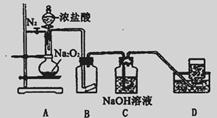
①检查装置气密性后,装入药品并连接仪器:
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量N2,至装置中气体无色。回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有__________(填化学式)生成。
若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因__________________________。
(2)装置C的作用是_________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①O2有可能是Na2O2与盐酸中的H2O反应所得:②___________________。
(4)实验证明,Na2O2与干燥的HC1能反应,该反应_______________(填“能”或“不能”)用于实验室快速制取纯净的C12,理由是(要求从两个不同的方面答出要点)
①_____________________;②_________________________________
【知识点】实验设计与评价J4 J5
【答案解析】(1)Cl2 (1分) 4H+ + 4I-+ O2 === 2I2 + 2H2O(2分)
(2)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气(2分)
(3)②Na2O2被还原时氧元素的化合价应该降低,不可能得到O2 (2分)
(4)不能(2分)
①Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O蒸汽混在Cl2中
(答出任何一点即可)(2分)
②实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢
(答出任何一点即可,其他合理答案均可)(2分)
解析:(1)装置B中的湿润的红色纸条褪色,证明A中反应有Cl2 生成。
若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,因为氧气也能将碘离子氧化得到碘单质,离子方程式是4H+ + 4I-+ O2 === 2I2 + 2H2O。
(2)装置C中盛有NaOH溶液,NaOH能与HCl、Cl2反应,所以作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①O2有可能是Na2O2与盐酸中的H2O反应所得,②Na2O2被还原时氧元素的化合价应该降低,不可能得到O2 。
(4)实验证明,Na2O2与干燥的HC1能反应,但该反应不适合实验室制取氧气,原因是实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢。
【思路点拨】本题考查了实验设计与评价,问题恒灵活,(3)(4)两问属于开放性问题,结合实验目的要敢想会想。


科目:高中化学 来源: 题型:
下图所示是验证氯气性质的 微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl—→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
研究下表信息可直接得出的结论是 ( )
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成难 易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 |
| H2、I2混合,加热化合,同时又分解 |
| 氢化物热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
A.元素性 质随原子序数的递增而呈周期性变化
质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强
C.第ⅦA族元素的金属性随电子层数增加而减弱
D.第ⅦA族元素的非金属性随电子层数增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)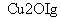
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )
A.前20 min内的反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
I、某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
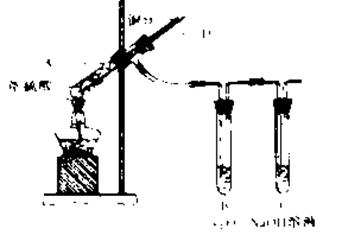
实验步骤:
①先连接好装置,检查气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____________________.
(2)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是_________________.
(3)若将B中品红溶液换成溴水,通入一段时间后溴水褪色,这说明了二氧化硫具有漂白性,你是否同意这个观点___________,(填“同意”或“不同意”),说明理由_________(用离子方程式表示)。
II、以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体。其过程如下图所示。
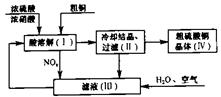
回答下列问题:
(4)配平在滤液(III)中发生反应的化学方程式:
_____NOx+____H2O+___O2=____HNO3
(5)写出制取硫酸铜的总反应方程式:_______________________.
(6)在上述生产过程中,被循环使用的物质是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,完成以下有关问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:
① ;⑥ ;⑦ ;⑪ 。
(2)在这些元素中,最活泼的金属元素是 ;最活泼的非金属元素是 ;最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是 ;碱性最强的是 ;呈两性的氢氧化物是 ;写出三者之间相互反应的化学方程式
;
;
。
(4)在这些元素中,原子半径最小的是 ;原子半径最大的是 。
(5)④和⑧形成的化合物中含有的化学键类型是 ;其电子式为 。
(6)在⑧和⑫中,非金属性较强的是 ;写出能体现非金属性强弱的一个化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的有关叙述正确的是 ( )
A.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
B.用食醋浸泡有水垢的水壶清除其中的水垢
C.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
D.用乙醇从碘水中萃取碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com