
|


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:

| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
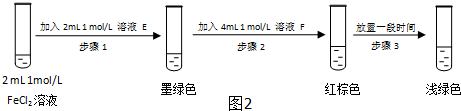
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O |
| B、硫酸和氯化钡溶液反应 Ba2++SO42-═BaSO4↓ |
| C、氢氧化钠和足量二氧化碳反应 2OH-+CO2═CO32-+H2O |
| D、铁钉放入硫酸铜溶液中 Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等浓度的NH4HSO4、NH3?H2O、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大 |
| B、NaClO和BaCl2混合溶液:c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-) |
| C、25℃下,0.2 mol?L-1 HCl溶液与0.2 mol?L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol?L-1 |
| D、常温下,将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小 |
| B、溶度积常数Ksp只受温度影响,温度升高Ksp减小 |
| C、溶度积常数Ksp只受温度影响,温度升高Ksp增大 |
| D、常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用盐酸冲洗 |
| C、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com