
【题目】按要求回答下列问题:
(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S![]() 6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为____;该晶体中原子之间的作用力是____。
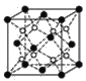
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为____。
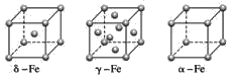
(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为____,δ、α两种晶胞中铁原子的配位数之比为____。
【答案】![]() Cu2O S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O; 3:1 金属键 H8AuCu3 4 4:3
Cu2O S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O; 3:1 金属键 H8AuCu3 4 4:3
【解析】
⑴Cu位于第四周期IB族,29号元素,因此其电子排布式为1s22s22p63s23p63d104s1,29Cu的外围电子排布式为3d104s1,其外围电子轨道表示式为![]() ,Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;
,Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;
故答案为:![]() ;Cu2O;S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O;
;Cu2O;S2-的半径大于O2-的半径,Cu2O键能大于Cu2S的键能,Cu2O晶格能大,因此Cu2S的沸点低于Cu2O;
⑵一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,即6×![]() =3,Au原子处于顶点,即8×
=3,Au原子处于顶点,即8×![]() =1,因此合金中Cu原子与Au原子数量之比为3:1,该晶体为金属晶体,因此原子之间的作用力是金属键,
=1,因此合金中Cu原子与Au原子数量之比为3:1,该晶体为金属晶体,因此原子之间的作用力是金属键,
故答案为:3:1;金属键;
⑶氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,因此根据图中信息得出氢原子共有8个,因此该晶体储氢后的化学式应为H8AuCu3,
故答案为:H8AuCu3;
⑷γ晶体晶胞中是面心晶胞,所含有的铁原子数为![]() ,δ是体心立方,配位数为8,α是简单立方,配位数为6,因此两种晶胞中铁原子的配位数之比为4:3,
,δ是体心立方,配位数为8,α是简单立方,配位数为6,因此两种晶胞中铁原子的配位数之比为4:3,
故答案为4;4:3。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在CH3COOH分子中的所有碳原子和氧原子都在同一平面
B.在 中单体为
中单体为![]() 和NC-CHO
和NC-CHO
C.1mol 与NaOH溶液完全反应,消耗NaOH5mol
与NaOH溶液完全反应,消耗NaOH5mol
D.![]() 与Br21︰1加成可有4种加成产物
与Br21︰1加成可有4种加成产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)有人设想合成具有以下结构的烃分子
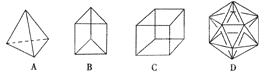
结构______________显然是不可能合成的,B的一种同分异构体是最简单的芳香烃(含苯环),能证明该芳香烃中的化学键不是单双键交替排列的事实是______________。
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(2)CO2 的有效利用可以缓解温室效应和能源短缺问题。CO2 的电子式是_____。中科院的科研 人员在 Na-Fe3O4 和HMCM-22 的表面将 CO2 转化为烷烃,其过程如图。
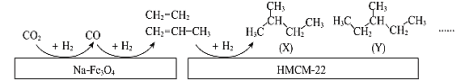
①Na-Fe3O4 和HMCM-22 在反应中的作用为_________________
②(X)的系统命名的名称为_____________________
(3)如图是乙酸乙酯的绿色合成路线之一:
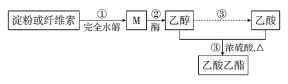
①M 的分子式为_____。
②下列说法不正确的是_____(填字母序号)。
A.淀粉和纤维素都属于天然高分子化合物
B.M 可与新制的氢氧化铜悬浊液在加热条件下生成砖红色沉淀
C.所有的糖类都有甜味,都可以发生水解反应
D.用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
(4)乙醇分子结构中的化学键如图所示:
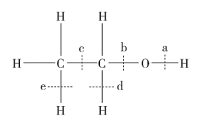
①乙醇在铜作催化剂时与氧气反应,断裂的化学键是_____(填字母 序号)。
②乙醇和乙酸在一定条件下制备乙酸乙酯。生成乙酸乙酯的反应是可逆反应,下列能说明该反应已达到化学平衡状态的是_____(填序号)。
A.单位时间里,生成 1mol 乙酸乙酯,同时生成 1mol 水
B.单位时间里,生成 1mol 乙酸乙酯,同时生成 1mol 乙酸
C.单位时间里,消耗 1mol 乙醇,同时消耗 1mol 乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的物质的量相等
Ⅱ.苧烯有新鲜橙子香气,结构简式为![]() 。回答下列问题:
。回答下列问题:
(1)下列有关苧烯的说法正确的是_____
a.苧烯属于芳香烃 b.苧烯与 1,3-丁二烯互为同系物
c.苧烯分子中键角均为 120° d.苧烯不能发生 1,4-加成反应
(2)有机物A 是苧烯的同分异构体,分子中含有两个六元环,能使溴水褪色,一氯代物只有两种,则A的结构简式为_____。
(3)苧烯在较高温度下分解为异戊二烯,异戊二烯发生加聚反应得到 4 种聚异戊二烯,其结构简式为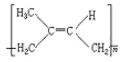 、
、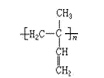 、__________、_________。
、__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺式乌头酸是一种重要的食用增味剂,其结构简式如图所示。下列有关说法错误的是( )
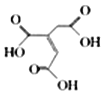
A.该有机物的分子式为:C6H6O6
B.该有机物分子中含有两种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.相同条件下,等量的顺式乌头酸分别与足量的NaHCO3、Na反应,产生气体的体积比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )

A.X、Y、Z分子中均含有2个手性碳原子
B.X、Y、Z均能与FeCl3溶液发生显色反应
C.1molY最多能消耗2molH2
D.1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
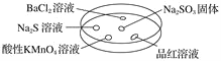
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中很多规律![]() 性质
性质![]() 都有其适用范围,下列根据其推出的结论正确的是( )
都有其适用范围,下列根据其推出的结论正确的是( )
选项 | 规律 | 结论 |
A | 主族元素最高正化合价等于族序数 | 第ⅦA族元素最高正价都是+7 |
B | SO2和湿润的 | 二者混合后漂白性更强 |
C | 常温下铜与浓硝酸反应可以制取 | 常温下铁与浓硝酸反应也可以制取 |
D | 较强酸可以制取较弱酸 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
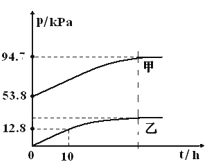
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
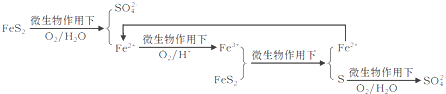
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com