
将10 mL NO和NO2的混合气体通入装满水的倒立在水槽中的量筒里,充分反应后,最后剩余6mL气体,则原混合气体中NO的体积为
A、1mL B、4mL C、5mL D、7mL
科目:高中化学 来源: 题型:
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如下图所示,其中符合图像的一组是( )
| 甲 | 乙 |
| |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
| D | NaAlO2、氨水、NaOH | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入明矾晶体 ⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体
A.①②④⑤ B.①④⑤
C.③④⑤ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
以下事实,表明硝酸具有强氧化性的是
A.硝酸可以和大理石反应
B.氢氧化铁沉淀可溶于硝酸
C.分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟
D.铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列选项的括号内是除去杂质所用的试剂,其中错误的是
A.氢气中混有二氧化硫(氢氧化钠溶液)
B.硫酸亚铁溶液中含有硫酸铜(锌粉)
D.二氧化碳中混有二氧化硫(小苏打溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取
SO2反应的化学方程式为:Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O,产生的气体通入下图所示装置:
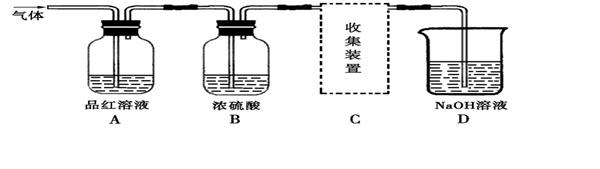
【实验探究】
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况,Na2SO3的摩尔质量为126g·mol-1),该制取SO2的反应___________(填“是”或“不是”)氧化还原反应。
(2)A装置观察到的现象是______________,说明SO2具有___________(填“漂白性”或“还原性”)。
(3)B装置中浓硫酸的作用是___________(填“干燥剂”或“氧化剂”)。
(4)D装置的作用是______________________
【实验讨论】
对上图中的C处,甲乙两同学都选用右图装置,但对连接方式持有不同意见。
 甲同学认为:SO2气体应从a处通入集气瓶中。
甲同学认为:SO2气体应从a处通入集气瓶中。
乙同学认为:SO2气体应从b处通入集气瓶中。
你认为___________(填“甲”或“乙”)同学的看法是正确的。
(已知:同等条件下二氧化硫的密度大于空气)
【联系实际】
SO2对环境的影响较大,为了减少SO2对空气的污染,请你提出一种有效的措施________________________ ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
A.8;BaTi8O12 B.8;BaTi4O9
C.6;BaTiO3 D.3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。
请回答下列问题:
(1)X元素原子基态时的电子排布式为______________________________________,
该元素的符号是________;
(2)Y元素原子的价层电子的电子排布图(轨道表示式)为____________,该元素的名称是______________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________________________________________________________;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性,并说明理由。稳定性由大到小的顺序:________________________(用化学式表示);
原因______________ __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下Ksp(AgCl)=1.8×10-10mol2/L2;Ksp(AgI)=1.0×10-16mol2/L2。下列说法中正确的是( )
A.在相同温度下AgCl的溶解度小于AgI的溶解度
B.AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于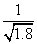 ×10-11mol·L-1
×10-11mol·L-1
D.将足量的AgCl分别放入下列物质中:①20 mL 0.01 mol·L-1KCl溶液,②10 mL 0.02 mol·L-1CaCl2溶液,③30 mL 0.05 mol·L-1AgNO3溶液,AgCl的溶解度由大到小的顺序为③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com