
分析 (1)先计算混合后溶液中KNO3的总质量和溶液的总质量,然后代入ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算;
(2)代入n=$\frac{m}{M}$计算混合后KNO3的物质的量,代入V=$\frac{m}{ρ}$计算混合后溶液的体积,然后代入c=$\frac{n}{V}$计算浓度;
(3)混合后c(K+)=c(KNO3).
解答 解:(1)混合后溶液中KNO3的总质量为20.0g×14.0%+30.0g×24.0%=10.0g,溶液总质量为20.0g+30.0g=50.0g,
混合后溶液的溶质质量分数ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%=$\frac{10.0g}{50.0g}$×100%=20%,
故答案为:20%;
(2)混合后KNO3的物质的量n(KNO3)=$\frac{10.0g}{101g/mol}$=0.099 mol,
混合后溶液的体积V=$\frac{50.0g}{1.15g/cm{\;}^{3}}$=43.5 cm3=0.0435 L,
混合后溶液的物质的量浓度c(KNO3)=$\frac{n}{V}$=$\frac{0.099mol}{0.0435L}$=2.28 mol/L,
故答案为:2.28 mol/L;
(3)混合后溶液中c(K+)=c(KNO3)=2.28 mol/L,
故答案为:2.28 mol/L.
点评 本题考查质量分数和物质的量浓度的相关计算,难度不大,注意V=$\frac{m}{ρ}$计算出来的数据单位要转化为L,然后代入c=$\frac{n}{V}$计算浓度.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
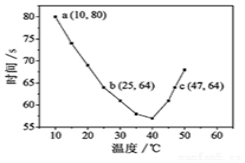 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 不能比较图中b、c两点对应的NaHSO3反应速率的大小 | |
| C. | 图中b点对应的NaHSO3反应速率为3.125×10-4mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该试验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$的比值为( )| A. | V2-V1 | B. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | C. | $\frac{{V}_{1}}{{V}_{2}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mL 1.5 mol•L-1的AgNO3溶液 | B. | 10mL 2 mol•L-1的NaCl溶液 | ||
| C. | 5mL 1 mol•L-1的AlCl3溶液 | D. | 5mL 1.6mol•L-1的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO32- | |
| B. | 加入Ba(NO3)2 溶液,生成白色沉淀,加入稀盐酸后沉淀不溶解时,可确定有SO42-存在 | |
| C. | 加入CCl4,振荡,静置,下层溶液呈紫色,则原溶液中存在碘单质 | |
| D. | 加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解时,可确定有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L | |
| B. | 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol | |
| C. | 若有0.4 mol HCl参加反应,则可制得氯气2.24 L | |
| D. | 若有0.4 mol HCl被氧化,则可制得氯气2.24 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com