
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 蓝矾 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 硝酸 | 苏打 | 氧化钠 | 干冰 |
| A. | A | B. | B | C. | C | D. | D |
分析 碱指电离时产生的阴离子全部都是氢氧根离子的化合物;
酸是指电离产生的阳离子都氢离子的化合物;
盐指电离时生成金属阳离子(或NH4+)和酸根离子的化合物;
碱性氧化物是指与酸反应只生成盐和水的氧化物;
酸性氧化物是指与碱反应只生成盐和水的氧化物.
解答 解:A.纯碱是碳酸钠,属于盐,烧碱是氢氧化钠是碱,不属于盐,氧化铝为两性氧化物,故A错误;
B.一氧化碳不能够与氢氧化钠反应,不是酸性氧化物,故B错误;
C.过氧化钠与酸反应生成盐和水,还生成氧气,不符合碱性氧化物概念,不是碱性氧化物,故C错误;
D.苛性钾是碱,硝酸是酸,苏打是碳酸钠属于盐,氧化钠是碱性氧化物,干冰即二氧化碳是酸性氧化物,故D正确;
故选:D.
点评 本题是对物质的化学式及分类的考查,对物质的名称、分类及化学式有较明确的认识即可顺利解答,属基础知识考查题,难度不大.


科目:高中化学 来源: 题型:解答题
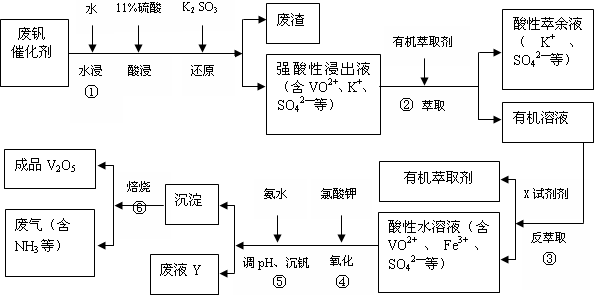
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
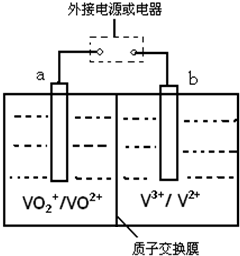
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
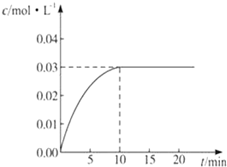 在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:
在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨电极电解加有酚酞的饱和食盐水,由于氢氧根离子向阳极移动,所以阳极区溶液首先变为红色 | |
| B. | 在铁管上镀锌时,铁管与直流电源的正极相接 | |
| C. | 给蓄电池充电时,直流电源的正极与蓄电池的正极相接,发生氧化反应 | |
| D. | 粗铜中含有少量锌、银等金属,电解精炼该粗铜时,阳极只发生的反应是:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤>②>④>③>① | B. | ④>①>③>②>⑤ | C. | ⑤>④>②>①>③ | D. | ④>③>⑤>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则平衡时c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | .6 | 7.5 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com