
| A. | 食盐水、牛奶、豆浆 | B. | 碘酒、泥水、血液 | ||
| C. | 白糖水、食盐水、茶叶水 | D. | Ca(OH)2悬浊液、澄清石灰水、石灰浆 |
分析 溶液、胶体、浊液是三种不同的分散系,分散系按照分散质的直径大小可分为溶液、胶体、浊液,
A.牛奶为蛋白质形成的分散系为胶体;
B.碘酒是碘单质的水溶液,泥水是浊液,血液为胶体;
C.食盐水为溶液不是浊液;
D.氢氧化钙悬浊液为浊液,石灰浆为浊液.
解答 解:A.食盐水是氯化钠的水溶液,牛奶、豆浆都是胶体,故A错误;
B.碘酒是碘单质的水溶液,泥水是浊液,血液为胶体,故B正确;
C.白糖水是蔗糖水溶液,食盐水是氯化钠水溶液,茶叶水是溶液,故C错误;
D.Ca(OH)2悬浊液为浊液,澄清石灰水是溶液,石灰浆为浊液,故D错误;
故选B.
点评 本题考查三种分散系的本质区别即分散质直径的大小,题目难度不大,主要是物质形成分散系的实质理解应用,注意审题仔细.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 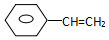 +4H2$\stackrel{一定条件}{→}$ +4H2$\stackrel{一定条件}{→}$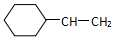 | |
| C. | 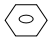 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$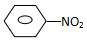 +H2O +H2O | |
| D. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
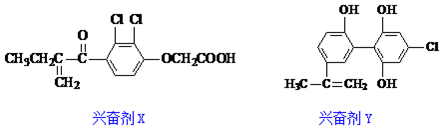
| A. | Y遇到氯化铁溶液时显紫色,但不能使溴的四氯化碳溶液褪色 | |
| B. | X既可以发生氧化反应,又可以发生还原反应 | |
| C. | 1molX与足量氢气反应,最多可消耗6molH2 | |
| D. | 1molY分子中最多有8个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 10:11 | C. | 4:1 | D. | 5:22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com