
【题目】某小组为测定化合物Co(NH3)yClx(其中Co为+3价)的组成,进行如下实验。
(1)氯的测定:准确称取2.675g该化合物,配成溶液后用1.00mol·L-1AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀(Ag2CrO4为砖红色)且不再消失时,消耗AgNO3溶液30.00mL。[已知:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12]
①AgNO3标准溶液需要放在棕色的滴定管中的原因是__。(用化学方程式表示)
②若滴定终点读数时滴定管下口悬挂了一滴液体,会使得测定结果__。(填“偏大”、“偏小”、“无影响”)
③用K2CrO4溶液作指示剂的理由是__。
(2)氨的测定:再准确称取2.675g该化合物,加适量水溶解,注入如图4___。(填仪器名称)中,然后通过仪器3滴加足量的NaOH溶液,加热1装置,产生的氨气被5中的盐酸吸收,多余的盐酸再用NaOH标准溶液反滴定,经计算,吸收氨气消耗1.00mol·L-1盐酸60.00mL。

装置A在整个实验中的作用是__,如果没有6中的冰盐水,会使得测定结果___(填“偏大”、“偏小”、“无影响”)。
(3)通过处理实验数据可知该化合物的组成为___。
【答案】2AgNO3![]() 2Ag↓+2NO2↑+O2↑ 偏大 Ag2CrO4为砖红色,由Ksp可知AgCl的溶解度更小,当溶液中Cl-消耗完时,才会产生砖红色沉淀 三颈烧瓶 产生水蒸气,将装置B中产生的氨气全部蒸出 偏大 [Co(NH3)6]Cl3
2Ag↓+2NO2↑+O2↑ 偏大 Ag2CrO4为砖红色,由Ksp可知AgCl的溶解度更小,当溶液中Cl-消耗完时,才会产生砖红色沉淀 三颈烧瓶 产生水蒸气,将装置B中产生的氨气全部蒸出 偏大 [Co(NH3)6]Cl3
【解析】
Co(NH3)yClx中Co的化合价为+3,NH3为0,Cl为-1,则x=3,通过实验测出NH3和Cl的物质的量之比即得出结果。
(1)①AgNO3不稳定,见光易分解成Ag和NO2和O2,发生的反应为:2AgNO3![]() 2Ag↓+2NO2↑+O2↑,故答案为:2AgNO3
2Ag↓+2NO2↑+O2↑,故答案为:2AgNO3![]() 2Ag↓+2NO2↑+O2↑;
2Ag↓+2NO2↑+O2↑;
②若滴定终点读数时滴定管下口悬挂了一滴液体,使得V2读数偏大,导致滴定结果骗大,故答案为:偏大;
③一方面Ag2CrO4为砖红色,另一方面由Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12可知,AgCl饱和溶液中c(Ag+)=![]() mol/L,Ag2CrO4饱和溶液中c(Ag+)=
mol/L,Ag2CrO4饱和溶液中c(Ag+)=![]() ×10-4mol/L,所以,AgCl的溶解度更小,当滴入AgNO3时溶解度小的沉淀先形成,当AgCl形成的差不多的时候,溶液中Cl-几乎沉淀完了,此时再滴AgNO3溶液就会立刻产生Ag2CrO4,即终点的时候会产生砖红色沉淀,故答案为:Ag2CrO4为砖红色,由Ksp可知AgCl的溶解度更小,当溶液中Cl-消耗完时,才会产生砖红色沉淀;
×10-4mol/L,所以,AgCl的溶解度更小,当滴入AgNO3时溶解度小的沉淀先形成,当AgCl形成的差不多的时候,溶液中Cl-几乎沉淀完了,此时再滴AgNO3溶液就会立刻产生Ag2CrO4,即终点的时候会产生砖红色沉淀,故答案为:Ag2CrO4为砖红色,由Ksp可知AgCl的溶解度更小,当溶液中Cl-消耗完时,才会产生砖红色沉淀;
(2)图4为三颈烧瓶,装置A的作用是产生水蒸气,将装置B中产生的氨气全部蒸出,如果没有6的冰盐水,HCl吸收氨气时可能形成倒吸,溶液中的HCl有一部分被倒吸,被反滴定的HCl的量就少,计算吸收氨气时的HCl就偏大,氨气的含量就偏大,故答案为:三颈烧瓶;产生水蒸气,将装置B中产生的氨气全部蒸出;偏大;
(3)滴定Cl-时,2.675g样品消耗30mL 1.00mol·L-1AgNO3,所以n(Cl-)=n(Ag+)=1.00mol·L-1×30mL×10-3=0.03mol,测定氨时,2.675g样品消耗1.00mol·L-1盐酸60.00mL,所以n(NH3)=n(HCl)= 1.00mol·L-1×60.00mL×10-3=0.06mol,故n(Cl-):n(NH3)=0.03:0.06=1:2,由于化合物Cox(NH3)yClx中Co的化合价为+3,NH3的化合价为O,Cl的化合价为-1,所以x=3,y=6,该化合物为:[Co(NH3)6]Cl3,故答案为:[Co(NH3)6]Cl3。


科目:高中化学 来源: 题型:
【题目】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__(填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJmol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液__(填“a”或“b”)。
②写出N极的电极反应:__。
③装置中使用___离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C.已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol。假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:

(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于____中(填“甲”或“乙”);G管可以用化学实验室里的一种常用仪器代替,你认为这种仪器的名称是____。仪器甲、乙接口的连接方式如下:A连接___,C连接F;(填写接口的编号)
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是_______。
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是___。
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
③根据以上数据得出Na2SO3的质量分数为_____。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是______,验证方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100℃的温度下(本题涉及的溶液温度均为100℃),水的离子积KW=1×10-12。下列说法正确的是
A.0.001 mol/L的NaOH溶液pH=9
B.0.1 mol/L的H2SO4溶液pH=1
C.0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
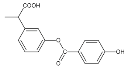
①分子式为C16H14O5 ②能使酸性高锰酸钾溶液褪色 ③能发生加成反应,但不能发生取代反应 ④苯环上的一溴代物有6种 ⑤1mol 该有机物与NaOH反应时最多消耗4mol NaOH ⑥1mol该有机物在一定条件下和H2反应,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实能说明HNO2是弱电解质的是
①HNO2溶液与NaHCO3溶液混合,放出气泡
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1
⑤相同浓度时,HNO2溶液的导电能力比盐酸弱
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,pH>2
A.①②③B.④⑤⑥C.①③④D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是( )
A.图甲表示向CH3COOH溶液中逐渐加入少量CH3COONa固体后,溶液pH的变化
B.图乙表示用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1醋酸溶液的滴定曲线
C.图丙表示电解法处理污水的原理,生成的胶体能除去污水中的悬浮物,该装置中的铁片可用铝片代替
D.图丁表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com