
【题目】根据要求填空:
(1)写出有机物![]() 的名称________。
的名称________。
(2)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为______。
(3)化学与生活息息相关。下列叙述正确的是___(填字母代号)。
A.馒头越嚼越甜 B.鲜榨橙汁遇到碘水会变蓝
C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒
(4)某化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为_______(写出一种即可)。
(5)瑞香素是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。
![]()
①瑞香素的化学式为____,含氧官能团名称____;
②1mol此化合物可与______molBr2反应,最多可以与____molNaOH反应。
(6)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示为HCHO+2Cu(OH)2+NaOH![]() HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
【答案】2,3,5-三甲基-4-乙基庚烷 20 A CH3CH2COOH或HCOOCH2CH3 C9H6O4 酯基、羟基 3 4 向足量氢氧化钠溶液中滴加几滴硫酸铜溶液,振荡,然后加入甲酸,加热至沸。如果出现砖红色沉淀,表明甲酸盐会继续与氢氧化铜反应,甲醛的氧化产物不是甲酸盐
【解析】
(1)![]() 的主链有7个碳原子,含有3个甲基和1个乙基;
的主链有7个碳原子,含有3个甲基和1个乙基;
(2)在酯化反应中羧酸提供羟基,醇提供羟基上的氢原子,当乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者在一定条件下反应生成的水是H218O;
(3)A、唾液中含有淀粉酶,可将淀粉水解为葡萄糖;
B、鲜榨橙汁不含淀粉;
C、油脂水解生成高级脂肪酸和甘油;
D、土豆中的淀粉水解生成葡萄糖;
(4)化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,说明此有机物中有三种不等性氢原子,且个数比为3:2:1,由此推测其结构中含有-CH3、-CH2-、-COOH或-OOCH等基团;
(5)①由瑞香素的结构简式可知化学式和官能团;
②瑞香素的官能团为碳碳双键、酚羟基和酯基,碳碳双键、酚羟基能与溴水反应,酚羟基和酯基能与氢氧化钠溶液反应。
(1)![]() 的主链有7个碳原子,含有3个甲基和1个乙基,名称为2,3,5-三甲基-4-乙基庚烷,故答案为:2,3,5-三甲基-4-乙基庚烷;
的主链有7个碳原子,含有3个甲基和1个乙基,名称为2,3,5-三甲基-4-乙基庚烷,故答案为:2,3,5-三甲基-4-乙基庚烷;
(2)在酯化反应中羧酸提供羟基,醇提供羟基上的氢原子,当乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者在一定条件下反应生成的水是H218O,H218O的相对分子质量水18+1×2=20,故答案为:20;
(3)A、唾液中含有淀粉酶,可将淀粉水解为葡萄糖,故馒头越嚼越甜,故正确;
B、鲜榨橙汁不含淀粉,遇到碘水不会变蓝,故错误;
C、油脂是高级脂肪酸甘油酯,水解生成高级脂肪酸和甘油,故错误;
D、土豆中的淀粉水解生成葡萄糖,故错误;
A正确,故答案为:A;
(4)化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,说明此有机物中有三种不等性氢原子,且个数比为3:2:1,由此推测其结构中含有-CH3、-CH2-、-COOH或-OOCH等基团,则结构简式可能为CH3CH2COOH、HCOOCH2CH3等,故答案为:CH3CH2COOH或HCOOCH2CH3;
(5)①由瑞香素的结构简式可知化学式为C9H6O4,该分子中含氧官能团是酚羟基、酯基,故答案为:C9H6O4;酯基、羟基;
②1mol瑞香素含有2mol酚羟基,能与浓溴水发生取代反应消耗2molBr2,含有1mol碳碳双键,能与溴水发生加成反应消耗1molBr2,共消耗3molBr2;1mol瑞香素含有2mol酚羟基,能与氢氧化钠溶液反应消耗2molNaOH,含有1mol酚与羧酸形成的酯基,能与氢氧化钠溶液反应消耗2molNaOH,共消耗4molNaOH,故答案为:3;4;
(6)因新制氢氧化铜足量,甲酸盐中能与足量新制氢氧化铜浊液中加热条件下可进一步反应生成碳酸盐,若证明甲醛的氧化产物不是甲酸盐,可用过量的氢氧化钠溶液配制氢氧化铜浊液,然后加入甲酸,甲酸与过量氢氧化钠溶液反应生成甲酸钠,在碱性条件下加热,观察是否有砖红色沉淀生成,若有砖红色沉淀,说明甲醛的氧化产物是甲酸盐,若没有砖红色沉淀,说明甲醛的氧化产物不是甲酸盐,故答案为: 向足量氢氧化钠溶液中滴加几滴硫酸铜溶液,振荡,然后加入甲酸,加热至沸。如果出现砖红色沉淀,表明甲酸盐会继续与氢氧化铜反应,甲醛的氧化产物不是甲酸盐。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】(1)已知室温下BaSO4的Ksp =1.1×1010,欲使溶液中c(SO42-)≤1.0×106 mol·L1,应保持溶液中c(Ba2+)≥___________。
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为_______________
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。

下列有关溶液中离子浓度关系的叙述正确的是_____________。(错选不得分)
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) c(OH-) +c(CH3COOH)= 0.1mol·L1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
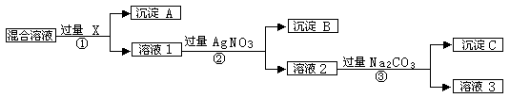
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X : ,沉淀A:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 mL 2 mol·L-1Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。
(1)已知: H2(g)+ ![]() O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+ ![]() O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
①保持温度、体积一定,能说明上述反应达到平衡状态的是_________。
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
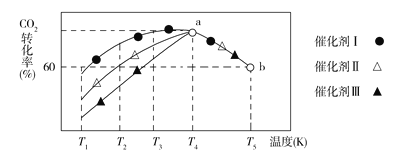
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂________(填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________。
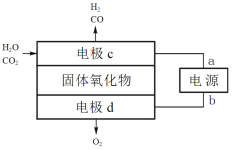
(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为________(填“a”或“b”),电极c上发生的电极反应式为________、_____。
②阴阳两极生成的气体的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把112 mL Cl2(标准状况下)完全转化为Cl-离子,则S2O32-将转化成
A.SO42-B.SO32-C.SD.S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是( )
A. 常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气
B. 用0.2000 /L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
C. 电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度
D. 在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com