
 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
分析 (1)该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,所以KMnO4的浓度不变,探究外界条件对反应速率的影响,需保证其他条件相同时来做实验;
(2)①KMnO4标准溶液用带玻璃活塞的酸式滴定管,待测液用锥形瓶盛放;利用高锰酸钾本身颜色判断滴定到终点;
草酸与高锰酸钾反应是锰离子和二氧化碳、水;
②盐酸会与酸性高锰酸钾反应,导致高锰酸钾消耗更多;
③根据关系式2KMnO4~5H2C2O4计算出草酸的物质的量,再根据关系式H2C2O4~CaC2O4~CaCO3计算碳酸钙的物质的量,最后得出质量分数.
解答 解:(1)该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,实验要求控制KMnO4溶液初始浓度相同,则KMnO4溶液的体积为20mL,根据实验②可知总体积为35mL,每次实验总体积都是35mL,则实验①加水的体积应为5mL,实验③加入草酸的体积应是5mL,实验①与实验②溶液PH不同,其他条件相同,则探究不同的初始pH对反应速率的影响,实验③与实验②探究草酸溶液浓度对反应速率的影响,所以溶液PH相同,应为5,
故答案为:
 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 5 | |||
| ② | 20 | |||
| ③ | 5 | 5 |
点评 本题考查了定量实验探究,是高考热点,涉及影响化学反应速率的因素和利用氧化还原滴定测定物质的含量,题目综合性强,注意在探究外界条件对反应速率的影响时控制变量法的使用,定量计算时注意实验过程中只是取了样品的一部分,容易忽略.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g•mol-1 | B. | 16 g•mol-1 | C. | 32 | D. | 64 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | |
| B. | Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐 | |
| C. | 二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | |
| D. | 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
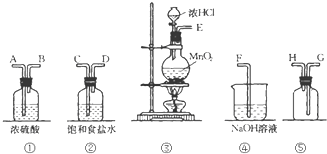 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
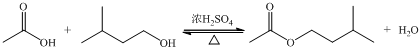
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
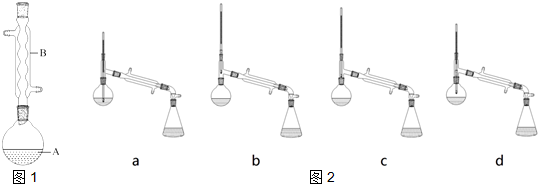
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com