
【题目】下列实验方法中,正确的是
①在家庭中用食醋和碘化钾淀粉试纸检验食盐是否是加碘![]() 盐
盐
②用酒精从碘水中萃取碘
③用加热的方法从碘和沙子的混合物中分离出碘
④实验室制![]() 、
、![]() 都用同一套装置
都用同一套装置
⑤用淀粉溶液直接检验![]()
⑥根据加入![]() 溶液产生白色沉淀的现象认定溶液中含
溶液产生白色沉淀的现象认定溶液中含![]()
⑦盛放液溴的试剂瓶内放少量蒸馏水防止液溴的挥发
⑧用溴水鉴别![]() 和
和![]()
A.①②③⑧B.③④⑥⑦C.①③⑦⑧D.②④⑥⑦
【答案】C
【解析】
①酸性溶液中![]() 、
、![]() 反应生成
反应生成![]() ,则用食醋、水和淀粉KI试纸检验加碘食盐中是否含
,则用食醋、水和淀粉KI试纸检验加碘食盐中是否含![]() ,故正确;
,故正确;
②酒精与水互溶,无法用酒精从碘水中萃取碘,可先用苯或四氯化碳,故错误;
③沙子比较稳定,而碘单质易升华,可用加热的方法从碘和沙子的混合物中分离出碘,故正确;
④实验室制![]() 直接加热即可,而制取乙烯需要将温度迅速升到
直接加热即可,而制取乙烯需要将温度迅速升到![]() ,两个实验不能用同一套装置,故错误;
,两个实验不能用同一套装置,故错误;
⑤碘单质与淀粉显示蓝色,碘离子没有该性质,无法用淀粉溶液直接检验![]() ,故错误;
,故错误;
⑥根据加入![]() 溶液产生白色沉淀的现象无法认定溶液中含
溶液产生白色沉淀的现象无法认定溶液中含![]() ,需要再加入稀硝酸检验,故错误;
,需要再加入稀硝酸检验,故错误;
⑦防止液溴挥发,溴微溶于水,所以盛放液溴的试剂瓶内放少量蒸馏水防止液溴挥发,故正确;
⑧C2H4与溴水发生加成反应使溴水褪色,而![]() 不与溴水反应,故用溴水鉴别
不与溴水反应,故用溴水鉴别![]() 和
和![]() ,故正确;
,故正确;
①③⑦⑧正确,故选C。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:![]()
![]()
![]() 在密闭容器反应,达到平衡状态的标志是( )
在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(2)(3)(4)(5)B.(2)(3)(4)C.(1)(3)(4)(5)D.(1)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物![]() 的结构简式如图
的结构简式如图![]() 的说法正确的是
的说法正确的是

A.![]() 中所含的化学键有离子键、共价键、配位键和氢键
中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为![]() 、
、![]()
C.![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]()
D.![]() 与
与![]() 互为等电子体,但空间构型不同
互为等电子体,但空间构型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,下列说法错误的是

A. 上图所涉及到的化学反应都是氧化还原反应
B. N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C. NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O
D. 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的是
实验目的 | 实验步骤 | |
A | 检验溶液中是否存在 | 用洁净的玻璃棒蘸取少量溶液在酒精灯上灼烧,观察火焰颜色 |
B | 检验久置的 | 取样配成溶液,加入盐酸酸化,再加 |
C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体依次通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
D | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京航空航天大学教授偶然中发现米虫吃塑料,受此启发进行了系列实验,证实黄粉虫的肠道微生物可降解聚苯乙烯(PS),蜡虫可降解聚乙烯(PE)。聚苯乙烯在虫肠内降解的示意图如下,下列说法正确的是

A. 在虫肠内微生物作用下,聚苯乙烯断裂碳碳双键
B. 在虫肠内微生物作用下,聚苯乙烯直接降解为CO2分子
C. 在虫肠内微生物作用下,聚苯乙烯发生降解,分子量降低
D. 聚乙烯与聚苯乙烯是同系物,具有烯烃的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2做反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3和浓硫酸净化气体
C.制氨气时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,不能达到实验目的是( )
A.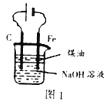 图1:实验室制备Fe(OH)2
图1:实验室制备Fe(OH)2
B.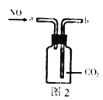 图2:收集NO气体
图2:收集NO气体
C.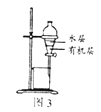 图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
D.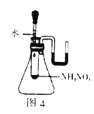 图4:可证明NH4NO3溶解时需要吸收热量
图4:可证明NH4NO3溶解时需要吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,合成硫酰氯的实验装置如下图:
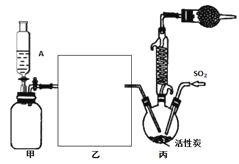
已知:①SO2(g)+Cl2(g)SO2Cl2(g) H=-97.3kJ/mol;
②硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内所缺装置为洗气瓶,瓶内应装的试剂是______________________。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______,分离产物的方法是(填字母)____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个简单实验验证二者是否恰好完全反应:__________(简要描述实验步骤、现象和结论)。仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com