
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
分析 根据同温同压,该混合气体相对于氢气的密度为12计算混合气体的平均摩尔质量,再利用平均摩尔质量计算混合气体中CH4的与O2的物质的量比,然后计算质量比.
解答 解:由pM=ρRT可知,
则混合气体的平均摩尔质量为12×2=24g/mol.
设混合气体中甲烷为xmol,氧气为ymol,
$\frac{16x+32y}{x+y}$=24g/mol,
解得x:y=1:1,
CH4的与O2的物质的量比为1:1,其质量比为$\frac{16×1}{32×1}$=1:2,
故选B.
点评 本题考查阿伏伽德罗定律的推论及物质的量的有关计算等,题目难度中等,也可利用十字交叉法计算气体的物质的量之比,简化计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝是指硝酸 | B. | 黑火药爆炸是氧化还原反应 | ||
| C. | 木炭在反应中做还原剂 | D. | 反应放热并产生大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 常温下c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、HCO3- | |
| D. | 透明溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:2OH-+CO2═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
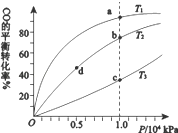
| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(b)>υ(d)v(a)>υ(c) | ||
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) | D. | 平均摩尔质量:M(b)>M(d)M(a)<M(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
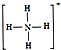 ,白磷(P4)的结构式为
,白磷(P4)的结构式为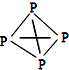 ,请画出N4H44+的结构式
,请画出N4H44+的结构式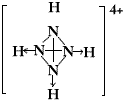 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的离子方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为5:3 | |
| C. | 上述苛性钾溶液中含有0.3mol的KOH | |
| D. | 反应后生成的ClO-和 ClO3- 两种离子在一定条件下均有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com