
| A、通入标准状况下的HCl气体22.4V L |
| B、将溶液加热浓缩到0.5V L |
| C、加入10.00 mol?L-1的盐酸0.2V L,再稀释至1.5V L |
| D、加入V L 3 mol?L-1的盐酸混合均匀 |
| n |
| V |
| c1V1+c2V2 |
| V |
| Vmol+2Vmol |
| 1.5VL |


科目:高中化学 来源: 题型:
 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D、可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一原子中一定没有能量相同的电子 |
| B、6C的电子排布式1s22s22px2违反了洪特规则 |
| C、电子排布式1s22s22p63s23p63d3违反了能量最低原理 |
| D、电子排布式1s22s22p63s23p10违反了泡利原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
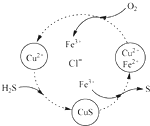 完成下列各小题的计算
完成下列各小题的计算查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na2O2+2CO2═2Na2CO3+O2↑ |
| B、2Na2O2+2SO3═2Na2SO4+O2↑ |
| C、Na2O2+H2SO4═Na2SO4+H2O2 |
| D、3Na2O2+Cr2O3═2Na2CrO4+Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com