
分析 (1)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
(2)明矾溶液中,铝离子部分水解,溶液显示酸性;
(3)硫酸铝与碳酸氢钠相互促进水解生成二氧化碳气体,用于灭火;
(4)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解;
(5)氯化铜中的铜离子易水解,加热促进水解,据此回答;
(6)根据二价铁易被氧化和发生水解反应分析;
(7)纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大.
解答 解:(1)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解离子方程式为NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(2)明矾溶液中铝离子发生水解反应:Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,故答案为:Al3++3H2O?Al(OH)3+3H+;
(3)泡沫灭火器工作原理的水解离子反应为Al3++3HCO3-═Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(4)氯化镁中的镁离子易水解,把MgCl2溶液加热蒸干,最终得到的固体是Mg(OH)2,要得到无水MgCl2,可以在干燥的氯化氢气流中加热水含氯化镁(MgCl2•6H2O)晶体,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2,
故答案为:Mg(OH)2;在干燥的氯化氢气流中加热水含氯化镁(MgCl2•6H2O)晶体;
(5)氯化铜中的镁铜子易水解,Cu2++2H2O?Cu(OH)2+2H+,把CuCl2溶液加热蒸干,促进水解,最终得到的固体是Cu(OH)2固体,故答案为:Cu(OH)2;氯化铜中的镁铜子易水解,Cu2++2H2O?Cu(OH)2+2H+,加热促进水解向右进行;
(6)因为二价铁易被氧化和发生水解反应,所以加入铁屑的目的是防止FeSO4被氧化,加入稀硫酸的目的是抑制FeSO4的水解,故答案为:防止FeSO4被氧化;抑制FeSO4的水解;
(7)纯碱水解显碱性,可促进油污的水解,而热的纯碱水解程度增大,水解离子反应为反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,
故答案为:纯碱水解显碱性,CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,加热,纯碱水解程度增大,碱性增强,酯的水解程度增大,所以洗涤油腻物效果更好.
点评 本题考查离子反应方程式书写及盐类水解,为高频考点,把握水解原理、相互促进水解反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 53g碳酸钠中含NA个CO32- | |
| B. | 0.1molOH-含NA电子 | |
| C. | 22.4LHCl溶于水,溶液中H+数为NA | |
| D. | 标准状况下11.2L臭氧(O3)中含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
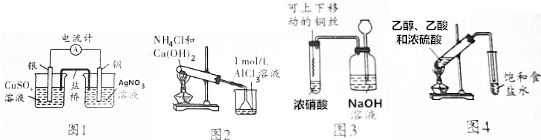
| A. | 用图1所示装置可将化学能转化为电能 | |
| B. | 用图2所示装置烧杯中先出现白色沉淀,后溶解 | |
| C. | 用图3所示装置进行铜与浓硝酸反应的实验 | |
| D. | 用图4所示装置制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
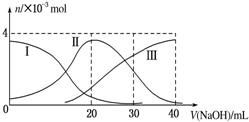
| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-?H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K(HF)=7.2×10-4 | B. | K(HNO2)=4.9×10-10 | ||
| C. | 反应NaCN+HF═HCN+NaF可以发生 | D. | K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com