
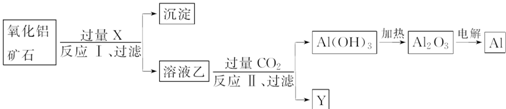
A、反应Ⅱ为CO2+2AlO
| ||
| B、CO2可以用H2SO4溶液或稀盐酸代替 | ||
| C、制取的铝单质与少量NaOH溶液反应的离子方程式为:Al+3OH-=Al(OH)3↓ | ||
| D、试剂X可以为NaOH溶液,沉淀中含有铁的化合物 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Ba2+、NO3-、OH- |
| B、H+、K+、CO32- |
| C、Cu2+、S2-、Cl- |
| D、Fe3+、Na+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 |
| B、Si和Ge的最外层电子数都是4,次外层电子数都是8 |
| C、用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 |
| D、石英砂与烧碱溶液反应制水玻璃的离子方程式:2Na++SiO2+2OH-═Na2SiO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一电离能:④>③>①>② |
| B、原子半径:②>①>③>④ |
| C、电负性:③>④>①>② |
| D、最高正化合价:④>①>③=② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 |
| B、在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 |
| C、硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱 |
| D、Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应中水被氧化成氧气 |
| B、该反应中水是氧化剂 |
| C、每生成1mol I2,转移的电子数为1mol |
| D、反应中氧化剂与还原剂的物质的量之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com