
【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
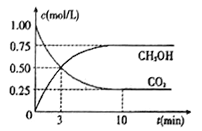
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
【答案】 ③④ 0.009(或0.01)mol/(L·s) 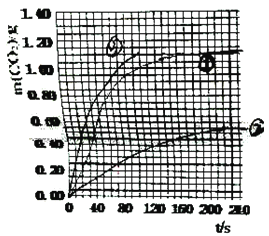 75% 0.075 a b
75% 0.075 a b
【解析】(1)由实验目的可知,探究浓度、接触面积、温度对化学反应速率的影响,实验①和②探究HNO3 浓度对该反应速率的影响,则变量是硝酸浓度;实验①③中只有温度不同,探究温度对该反应速率的影响;实验①④的温度、硝酸浓度相同,大理石规格不同,探究大理石规格(粗、细)对该反应速率的影响。(2)由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,由CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O可知消耗HNO3的物质的量为n(HNO3)=0.025mol×2=0.05mol,又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=0.2molL-1,反应的时间t=90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=△c/△t=0.01mol/(L·s);(3)由于②硝酸浓度是①的一半,所以反应速率比①小,生成的二氧化碳是①的一半;③中的硝酸浓度与①相同,所以生成的二氧化碳物质的量相等,但是温度③最高,反应速率最快,
根据以上画出实验②和③中CO2质量随时间变化关系的预期结果示意图为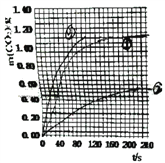 。4)①达到平衡时生成甲醇是0.75mol/L,消耗氢气是2.25mol/L,所以H2的转化率为2.25/3×100%=75%。在前10min内消耗CO2是1mol/L-0.25mol/L=0.75mol/L,因此用CO2表示的反应速率:V(CO2)=0.75mol/L÷10min=0.075mol/(L·min);②a.正反应体积减小,则容器压强不变说明反应达到平衡状态,a正确;b.混合气体中c(CO2)不变明反应达到平衡状态,b正确;c. v(CH3OH)=v(H2O)不能说明正逆反应速率相等,不一定处于平衡状态,c错误;d.c(CH3OH)=c(H2O) 不能说明正逆反应速率相等,不一定处于平衡状态,d错误,答案选ab。
。4)①达到平衡时生成甲醇是0.75mol/L,消耗氢气是2.25mol/L,所以H2的转化率为2.25/3×100%=75%。在前10min内消耗CO2是1mol/L-0.25mol/L=0.75mol/L,因此用CO2表示的反应速率:V(CO2)=0.75mol/L÷10min=0.075mol/(L·min);②a.正反应体积减小,则容器压强不变说明反应达到平衡状态,a正确;b.混合气体中c(CO2)不变明反应达到平衡状态,b正确;c. v(CH3OH)=v(H2O)不能说明正逆反应速率相等,不一定处于平衡状态,c错误;d.c(CH3OH)=c(H2O) 不能说明正逆反应速率相等,不一定处于平衡状态,d错误,答案选ab。


科目:高中化学 来源: 题型:
【题目】从海水中可以提取溴,主要反应为2Br-+Cl2=2Cl-+Br2,下列说法正确的是
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:

(1)甲烷水蒸气重整法制合成气的热化学方程式为_______;该反应只有在_____(填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_____(填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO![]() CO2+H2
CO2+H2
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____b点,a点CH4的浓度_____b点H2O(g)的浓度,氢气的产率a点_____b点。

(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________。

(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁处于同一周期,甲的原子半径是整个周期表中最小,丁原子的最外层电子数是甲、乙、丙原子最外层电子数之和。乙的气态氢化物X与其最高价氧化物的水化物能发生反应生成化合物Y。
(1)丙离子的结构示意图为________.甲和丙可形成化合物,该化合物为____(填“离子”或“共价”)化合物。用电子式表示该化合物的形成过程:____________。
(2)写出乙单质的电子式:_____________。以上四种元素原子的半径从大到小的顺序为______(填具体的元素符号)。
(3)Y中含有的化学键有_____________。
(4)丁所在的族各元素的氢化物中:沸点最低的是_______(填化学式),其中的某氢化物的水溶液不能用玻璃瓶贮存,用化学方程式解释其原因_________________
(5)己知丁的单质与一定量的X在一定条件下能反应生成乙的单质,同时生成两种化合物W 和Z, W是一种盐,Z是一种强酸,若W和Z的物质的量之比为2 : 4 ,写出丁的单质与X反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒沙特列原理解释的是 ( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g) ![]() N2O4 (g))
N2O4 (g))
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.用硫酸氢钠去除暖水瓶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态。
(1)①在元素周期表中,元素X位于 区,元素Y在周期表中的位置是 。
②Z所在周期中,第一电离能最大的元素是 (填元素名称)。
③X+的核外电子排布式为 。
④Y和W两元素最高价氧化物对应的水化物酸性较强的是 (填化学式)。
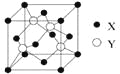
(2)X与Y所形成化合物晶体的晶胞如右图所示。在1个晶胞中,X离子的数目为 ;该化合物的化学式为 。
(3)①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是 。
②稳定性:H2Z H2W(填“>”、“<”或“=”),其主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com