
【题目】下列反应中,硫元素表现出氧化性的是
A. H2SO4+Zn=ZnSO4+H2↑ B. 2SO2+O2![]() 2SO3
2SO3
C. 2H2SO4(浓)+Cu![]() CuSO4(浓)+SO2↑+2H2O D. SO3+H2O=H2SO4
CuSO4(浓)+SO2↑+2H2O D. SO3+H2O=H2SO4
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Mg2+、Ag+、Ba2+ 3种阳离子,欲将3种离子逐一沉淀出来,下列加入试剂的顺序中,正确的是
①NaOH溶液、NaCl溶液、Na2SO4溶液
②NaOH溶液、Na2SO4溶液、NaCl溶液
③NaCl溶液、Na2SO4溶液、NaOH溶液
④NaCl溶液、NaOH溶液、Na2SO4溶液
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____,常温下测得NaHSO3溶液的pH<7,其原因是_____。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属腐蚀的本质是金属与其接触的其他物质在一定条件下发生氧化还原反应而受到损害。下列不属于化学或电化学防腐方法的是( )
A. 在金属表面涂刷一层油漆
B. 利用电镀技术在金属表面镀上一层其他金属
C. 用阳极氧化处理使铝表面形成致密的氧化物膜
D. 利用特殊工艺在钢铁表面生成一层致密的Fe3O4薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利用如图所示装置可以模拟铁的电化学防护,其中Y为NaCl。
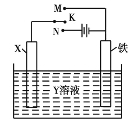
为减缓铁的腐蚀:
①若X为碳棒,开关K应置于 (填字母)处,此时X极发生的电极反应式为 。
②若X为锌,开关K置于M处,则此时铁极发生的电极反应式为 。
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质溶液均为NaCl溶液)。
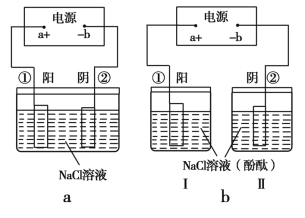
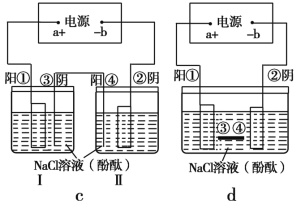
你认为其中能合理模拟金属管道的腐蚀原理的是 ;c(Ⅱ)的总反应方程式是 ;若图d 中接通电源,则平放的铁丝左侧附近产生的现象是 ;请你为防止地下金属管道腐蚀提供一种策略 。
Ⅱ.1 L某溶液中含有的离子如下表:
离子 | Cu2+ | Al3+ |
| Cl |
物质的量浓度/(mol/L) | 2 | 1 | 4 | x |
用惰性电极电解该溶液。当电路中有5 mol 电子通过时,溶液的pH= (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A. 非金属单质燃烧时火焰均为无色
B. 所有金属及其化合物灼烧时火焰均有颜色
C. 焰色反应均应透过蓝色钴玻璃观察
D. NaCl与Na2CO3灼烧时火焰颜色相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在酸性条件下, ![]() 水解的产物是
水解的产物是![]() 和
和![]()
B. 用甘氨酸(![]() )和丙氨酸(
)和丙氨酸(![]() )缩合,最多可形成4种二肽
)缩合,最多可形成4种二肽
C. ![]() 与NaOH的乙醇溶液混合后加热,将所得气体通入高锰酸钾酸性溶液中,若溶液褪色,则证明有乙烯生成
与NaOH的乙醇溶液混合后加热,将所得气体通入高锰酸钾酸性溶液中,若溶液褪色,则证明有乙烯生成
D. 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中原子利用率高,符合“绿色化学”要求的是
A. 乙烷与Cl2反应制氯乙烷
B. 乙醇和浓硫酸共热制乙烯
C. 乙酸和乙醇共热酯化
D. 乙烯在催化剂作用下直接氧化制得唯一产物乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com