


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

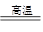 Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ,写出铝粉与所用试剂反应的离子方程式 。
Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ,写出铝粉与所用试剂反应的离子方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.周期表中有8个A族,8个B族 |
| B.目前使用的元素周期表中,最长的周期含有32种元素 |
| C.短周期元素是指1-20号元素 |
| D.原子及其离子的核外电子层数都等于该元素所在的周期数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| a | | | |||||||||||||||
| | | | | | e | f | g | | |||||||||
| | b | | | | hh | | | | |||||||||
| c | | | | | | | d | [ | d | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.全都正确 | B.①④⑥ | C.①④⑤ | D.②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com