
【题目】将1 mL 0.10 mol/L 硫酸加水稀释成 2 L 溶液,则溶液中由水电离产生的H+ 的浓度为( )
A.1×10-10 mol/L
B.1×10-8 mol/L
C.1×10-11 mol/L
D.1×10-4 mol/L
科目:高中化学 来源: 题型:
【题目】恒温、恒容的条件下对于N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日消息,诺贝尔化学奖颁给约翰●B.古迪纳夫、M●斯坦利●威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为__;基态磷原子第一电离能比基态硫的__(填“大”或“小”),原因是__。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是__,其中硫、碳的杂化类型分别是__、__。
(3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为__;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为__。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
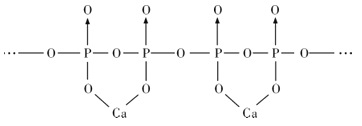
由图推知该多磷酸钙盐的通式为__。
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__,Fe2+与O2-最短核间距为___pm。
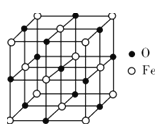
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )

A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:R—CH=CH2+HX→![]() (主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(1)A、B、C、D、E的结构简式____、____、____、____、____。
(2)由E转化为B、由A转化为E的化学方程式____、____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

(1)点①所示溶液中,Kw=__________。
(2)点②所示溶液中的电荷守恒式为______________________________________。
(3)点③所示溶液中存在________种平衡。
(4)点④所示溶液中的物料守恒式为0.10 mol·L-1=___________________________。
(5)点⑤所示溶液中各离子浓度的大小顺序为________________________________。
(6)上述5点所示溶液中,水的电离程度最大的是_______,最小的是________(用序号回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,

其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com