
化学反应N2+3H2 2NH3的能量变化如右图所示,该反应的热化学方程式是:
2NH3的能量变化如右图所示,该反应的热化学方程式是:
A.N2(g)+3H2(g)  2NH3(l) ΔH=2(a-b-c) kJ·mol-1
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)  2NH3(g) ΔH=2(b-a) kJ·mol-1
2NH3(g) ΔH=2(b-a) kJ·mol-1
C.  N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(l) ΔH=(b+c-a) kJ·mol-1
NH3(l) ΔH=(b+c-a) kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g) ΔH=(a+b) kJ·mol-1
NH3(g) ΔH=(a+b) kJ·mol-1

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定某无水亚硫酸钠试剂的纯度,设计了如下实验:

请回答下面问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?
。
(2)B装置中反应的离子方程式为 。
(3)称量agNa2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg。则原样品中Na2SO3的质量分数为 。
(4)C装置中发生反应的化学方程式为 。
(5)现有以下试剂:蒸馏水、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能证明HNO2是弱电解质的是( )
A. 用HNO2溶液做导电性试验灯光较暗
B. HNO2是共价化合物
C.常温下,0.1 mol/L HNO2溶液的pH为2.2
D. HNO2溶液不与NaCl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以氨气为原料制备硝酸的过程如图1所示:

某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 ;
(2)连接好装置后,首先进行的操作是 ;
(3)通入a气体的目的是 ;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是 。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是 ;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,共放出x kJ热量;已知每摩尔单质碳完全燃烧生成CO2放出热量为y kJ,则1mol C与O2反应生成CO的反应热△H为:(单位:kJ•mol﹣1)
A.-y ; B.-(10x﹣y); C.-(5x-0.5y); D.+(10x﹣y)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)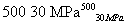 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可以反应:
反应Ⅰ: 2NH3(l) + H2O (l) + CO2 (g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ: NH3(l) + H2O (l) + CO2 (g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ: (NH4)2CO3(aq) + H2O (l) + CO2 (g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
 请回答下列问题:
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3= 。
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度
T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入
一定量的CO2(用氮气作为稀释剂),在t时刻,测得容器
中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,
保持其它初始实验条件不变,重复上述实验,经过相同
时间测得CO2气体浓度,得到趋势图(见图1)。
则△H3 0(填>、=或<)。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
能完全中和20 mL 1 mol /L NaOH溶液生成正盐的溶液是( )。
A.40 mL 0.1 mol /L盐酸 B.20 mL1 mol /L硫酸溶液
C.10 mL 1 mol /L硫酸溶液 D.5mL 1 mol /L磷酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
为了确定某物质是否变质,所选试剂(括号内物质)错误的是
A.Na2SO3是否被氧化(BaCl2) B.FeCl2是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液) D.氯水是否失效(pH试纸)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com