
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 甲烧杯比乙烧杯反应快 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
分析 A.醋酸浓度大,等体积的两种酸,醋酸的物质的量大于盐酸,产生等量的氢气,醋酸中锌的量要少与盐酸中锌的量;
B.盐酸的浓度小,生成等量的氢气,盐酸完全反应;
C.由于醋酸还能继续电离而盐酸不能,所以反应开始后,醋酸中的H+浓度大于盐酸中的氢离子浓度;
D.反应开始后,醋酸持续电离.
解答 解:A.在体积和pH都相等的盐酸和醋酸中,已提供的H+的浓度和其物质的量相等,但由于醋酸是弱酸,只有部分电离,盐酸是强酸,已经完全电离,所以可提供的H+的物质的量显然是醋酸大于盐酸,与足量的锌反应时,消耗锌的质量是醋酸大于盐酸,要使两种酸中生成的氢气的量相等,则在醋酸中加入的锌粒质量应较小,盐酸中加入的锌粒质量较大,故A正确;
B.当加入的锌粒质量不等而产生等量的氢气时,说明参加反应的锌粒相等,盐酸中加入的锌粒质量较大,盐酸一定完全反应,乙烧杯中醋酸一定有剩余,故B错误;
C.由于醋酸还能继续电离而盐酸不能,所以反应开始后,醋酸中的H+浓度大于盐酸中的氢离子浓度,乙比甲快,故C错误;
D.由于醋酸还能继续电离而盐酸不能,所以反应开始后,醋酸中的H+浓度大于盐酸中的氢离子浓度,则反应开始后乙烧杯中的C(H+)始终比甲烧杯中的c(H+)大,故D错误;
故选A.
点评 本题考查了强弱酸与金属反应的有关问题,明确弱电解质电离特点是解本题关键,结合转移电子相等、氢离子与酸浓度的关系来分析解答,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol H2含有的分子数目为NA | |
| B. | 24g Mg变为Mg2+时失去的电子数目为NA | |
| C. | 1L 1mol•L-1CaCl2溶液中含有的Cl-离子数目为NA | |
| D. | 常温常压下,11.2LO2中含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴有酚酞的碳酸氢钠溶液显红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠 | |
| B. | 用洁净的玻璃管向包有过氧化钠的脱脂棉吹气,脱脂棉燃烧,说明二氧化碳、水与过氧化钠的反应是放热反应 | |
| C. | 向溴水中滴入植物油,振荡后油层显无色,说明溴不溶于油脂 | |
| D. | 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
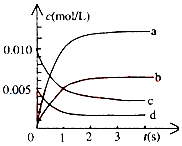 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
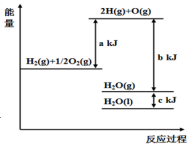
| A. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | 2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
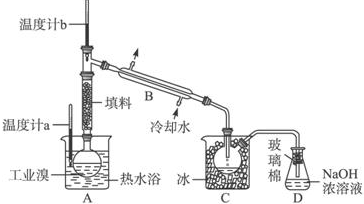
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. .
.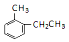 的名称是2-甲基乙苯.
的名称是2-甲基乙苯. +CH3COOH$?_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 的一种同分异构体的结构简式
的一种同分异构体的结构简式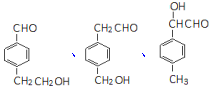 任一种.
任一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com