
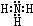 ,B的结构式为
,B的结构式为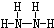 .
. .
.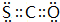 .
.分析 X、Y、Z、L、M五种元素的原子序数依次增大.X的一种核素没有中子,则X为H元素;Y是有机物的主要组成元素,则Y为C元素;L和M分别是地壳中含量最高的非金属元素和金属元素,则L为O元素、M为Al,Z的原子序数介于碳、氧之间,则Z为N元素.
解答 解:X、Y、Z、L、M五种元素的原子序数依次增大.X的一种核素没有中子,则X为H元素;Y是有机物的主要组成元素,则Y为C元素;L和M分别是地壳中含量最高的非金属元素和金属元素,则L为O元素、M为Al,Z的原子序数介于碳、氧之间,则Z为N元素.
(1)L的元素符号为O;M为Al元素,在元素周期表中的位置为第三周第ⅢA族;Z为N元素,元素的最高正价和最低负价分别为+5、-3,它的氢化物和最高价氧化物对应水化物反应的化学方程式为:NH3+HNO3=NH4NO3,
故答案为:O;第三周第ⅢA族;+5、-3;NH3+HNO3=NH4NO3;
(2)N、H两元素按原子数目比l:3和2:4构成分子A和B,则A为NH3、B为N2H4,A的电子式为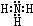 ,B的结构式为
,B的结构式为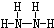 ,
,
故答案为: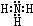 ;
;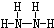 ;
;
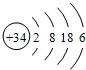
(3)硒(Se)是人体必需的微量元素,与L(氧)同一主族,Se原子比L(氧)原子多两个电子层,则Se的原子原子结构示意图为: ,
,
故答案为: ;
;
(4)所以元素中H原子半径最小,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故五种元素的原子半径从大到小的顺序是:Al>C>N>O>H,
故答案为:Al>C>N>O>H;
(用元素符号表示).
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,分子中S原子、氧原子与碳原子之间分别形成2对共用电子对,其电子式为: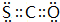 ,
,
故答案为: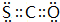 ;
;
(6)由X、Z、L三种元素组成的离子化合物为NH4NO3等,与稀NaOH溶液反应的离子方程式:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O.
点评 本题以元素推断为载体,考查结构性质位置关系、常用化学用语、元素周期律、元素化合物知识等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ 其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol稀H2SO4和足量KOH反应的反应热为△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 需要区分的物质 | 实验方法 | |
| A | 磷酸钙和氯化铵 | 溶于水 | 与熟石灰混合研磨 |
| B | 氢氧化钠固体和熟石灰 | 将两种固体溶于水 | 溶于水,向所得溶液中分别吹入CO2气体 |
| C | 硫酸钾和碳酸钾 | 加硝酸钡溶液 | 加水溶解 |
| D | 硬水和软水 | 肥皂水 | 加热、煮沸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a<b,则c(OH-)<c(H+) | B. | 若a>b,则c(NH4+)>c(Cl-) | ||
| C. | 若a>b,则c(OH-)>c(H+) | D. | 若a=b,则c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
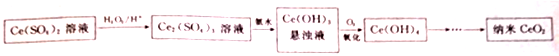
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
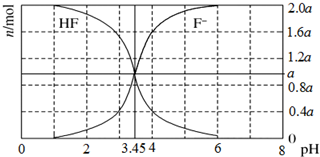 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3.45时,溶液中:c(Na+)+c(H+)=c(HF)+c(OH-) | |
| B. | pH=3时,溶液中:c(Na+)>c(F-) | |
| C. | n(F-)=0.6a mol时,溶液中:c(Na+)>c(HF) | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com