
煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42﹣;
4H++2Fe2++4SO42﹣;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2
4H++2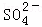 .
.
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是 .
(3)观察上述反应,FeS2最终转化为 从煤炭中分离出来.
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: (1)依据离子方程式的电荷守恒和原子守恒书写判断产物;
(2)还原剂是元素化合价反应后升高,结合化合价变化分析判断;
(3)依据四个反应分析判断产物;
解答: 解:(1)依据离子方程式的电荷守恒和原子守恒书写判断产物;反应①中为4SO42﹣,②反应中为2H2O,
故答案为:4SO42﹣,2H2O;
(2)还原剂是元素化合价反应后升高,反应③中硫元素化合价从﹣1价变化为0价,所以反应中的还原剂是FeS2;
(3)依据①②③④的离子方程式,分析判断最终的生成物为硫酸亚铁和硫酸,故答案为:FeSO4 H2SO4
点评: 本题考查了氧化还原反应的电荷守恒、原子守恒的应用,氧化还原反应概念的分析判断,掌握特征变化、分析反应实质,判断概念的由来.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
下列溶液中Cl﹣浓度最大的是()
A. 1L 0.1mol•L﹣1的KCl溶液
B. 0.2L 0.1mol•L﹣1的盐酸溶液
C. 0.1L 0.1mol•L﹣1的AlCl3溶液
D. 0.3L 0.1mol•L﹣1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. HClO4中氯元素化合价比HClO中氯元素化合价高,所以,HClO4的氧化性强
B. 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
C. 已知还原性:B﹣>C﹣>D﹣,反应2C﹣+D2=2D﹣+C2和反应 2C﹣+B2=2B﹣+C2都能发生
D. 已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是()

A. 该试剂的物质的量浓度为9.2 mol•L﹣1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C. 配制200 mL 4.6 mol•L﹣1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是()
A. 漂白粉溶液在空气中失效:ClO﹣+CO2+H2O═HClO+HCO3﹣
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl﹣ Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. 用小苏打治疗胃酸过多:HCO3﹣+H+=CO2↑+H2O
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
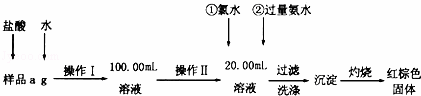
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为
(3)若不用氯水,可用下列试剂中的AC代替(填序号).
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 .
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 ×100%(请把结果约到最简).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式中,正确的是()
A. Al2(SO4)3=2Al+3+3SO4﹣2 B. K2SO4=2K++S6++4O2﹣
C. CuCl2=Cu2++2Cl﹣ D. Na2CO3=Na++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既属于氧化还原反应,又是吸热反应的是()
A. 铝片与稀盐酸的反应 B. 灼热的炭与CO2的反应
C. Ba(OH)2•8H2O与NH4Cl的反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是(设NA为阿伏加德罗常数的数值)( )
A. 20g重水含有10NA个电子
B. 1L 0.1 mol•L﹣1 Na2SO3溶液中含有的SO32﹣数目少于0.1NA个
C. 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
D. 用足量铜粉除去FeCl2溶液中的FeCl3杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com