
| 180℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |


科目:高中化学 来源: 题型:
| A、生成了一种强酸弱碱盐 |
| B、弱酸溶液与强碱溶液反应 |
| C、强酸溶液与强碱溶液反应 |
| D、一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Ca2+的浓度增大 |
| B、溶液中Ca2+的浓度减小 |
| C、溶液中pH不变 |
| D、溶液中pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)+I2(g)?2 HI(g) |
| B、3H2(g)+N2(g)?2NH3(g) |
| C、2SO2(g)+O2(g)?2SO3(g) |
| D、C(s)+CO2(g)?2CO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、稀释Na2CO3溶液时,
| ||||||
B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||||
| C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | ||||||
| D、常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
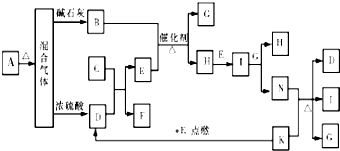
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com