
| A. | H2O2的溶液中:Na+,F-,SO32- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:K+、Ba2+、Cl-、NO3- | |
| D. | pH=1的溶液中:Na+,K+,Cl-,S2O32- |
分析 A.双氧水具有强氧化性,能够氧化亚硫酸根离子;
B.该溶液中存在大量氢氧根离子,亚铁离子与氢氧根离子反应;
C.由水电离的c(H+)=1×10-14mol•L-1的溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子、氢氧根离子反应;
D.pH=1的溶液中存在大量氢离子,S2O32-与氢离子反应.
解答 解:A.H2O2、SO32-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.该溶液呈碱性,溶液中存在大量氢氧根离子,Fe2+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.由水电离的c(H+)=1×10-14mol•L-1的溶液呈酸性或碱性,溶液中存在大量氢离子或企业广告离子,:K+、Ba2+、Cl-、NO3-之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.pH=1的溶液呈酸性,溶液中存在大量氢离子,S2O32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
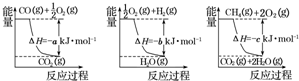
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )| A. | 平衡时Y的转化率为$\frac{a}{b}$% | |
| B. | 向容器中再加入少量X,则Y的转化率增大 | |
| C. | 再通入Y,重新达到平衡时W的体积分数不变 | |
| D. | 保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室蒸馏石油时,将温度计的水银球插入液面下 | |
| B. | 稀释浓硫酸时,将浓硫酸沿玻璃棒慢慢注入盛有水的烧杯内并不断用玻璃棒搅拌 | |
| C. | 用蒸发皿蒸发液体时,未垫上石棉网直接加热蒸发皿 | |
| D. | 配制一定物质的量浓度的溶液时,清洗后未经干燥的容量瓶直接用于实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-乙基-1,3-丁二烯的键线式: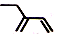 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 用溴水可鉴别苯、CCl4、苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况,1molH2O含O原子个数为NA | |
| B. | 1.12L N2中含N2分子数为0.05NA | |
| C. | 5.6gFe与足量稀盐酸反应,转移的电子数为0.3NA | |
| D. | 0.1molFeCl3可制得Fe(OH)3胶体的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氢氧化钠醋酸、干冰 | B. | 澄清的石灰水、铜、氨气 | ||
| C. | 石油、水、硫酸钡 | D. | 海水、氯化钠、氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
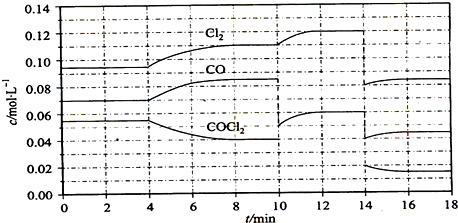
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com